
【题目】(1)请写出高温时铁和水蒸气反应的化学方程式:_______________。
(2)写出碳酸氢钠溶液中滴入氢氧化钠溶液的离子方程式:___________。
(3)装氢氧化钠溶液的试剂瓶不能用玻璃塞,请用离子方程式表示原因:______。
(4)写出镁条在足量的二氧化碳中燃烧的化学方程式:_______________。
【答案】3Fe + 4H2O![]() Fe3O4 + 4H2 HCO3- + OH-=CO32-+H2O 2OH-+SiO2=H2O+SiO32- 2Mg+CO2
Fe3O4 + 4H2 HCO3- + OH-=CO32-+H2O 2OH-+SiO2=H2O+SiO32- 2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
(1)高温时铁和水蒸气反应生成四氧化三铁和氢气的化学方程式为3Fe + 4H2O![]() Fe3O4 + 4H2;
Fe3O4 + 4H2;
(2)碳酸氢钠溶液中滴入氢氧化钠溶液生成碳酸钠和水,发生反应的离子方程式为HCO3- + OH-=CO32-+H2O;
(3)氢氧化钠与玻璃塞中的二氧化硅反应生成粘性物质硅酸钠,反应的离子方程式为:2OH-+SiO2=H2O+SiO32-;
(4)镁条在足量的二氧化碳中燃烧生成MgO和C,发生反应的化学方程式为2Mg+CO2![]() 2MgO+C。
2MgO+C。


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】T℃时气体A与气体B在某容器中反应生成气体C,反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图②所示。则下列结论正确的是( )

A.该反应的化学方程式是A+3B![]() 2C
2C
B.该反应的逆反应为吸热反应
C.压强增大,则该反应的正反应速率增大,逆反应速率减小
D.保持压强不变,向容器中充入少量氦气,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验 序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol﹒L-1 | V mL | c/mol﹒L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)写出草酸与高锰酸钾反应的离子方程式____________________________________。
(2)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(3)若t1<8,则由此实验可以得出的结论是______________________________________;忽略溶液体积的变化,利用实验B中数据计算,0-8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)________。
Ⅱ催化剂在生产和科技领域起到重大作用。某化学研究小组的同学分别设计了如图所示的实验,用控制变量法比较Fe3+和Cu2+对H2O2分解的催化效果。请回答相关问题:
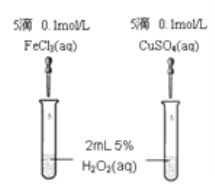
(4)定性某同学通过观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,该结论_____填 (“合理”或“不合理”),原因________________。
(5)向50ml H2O2溶液中加入0.10molMnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示。
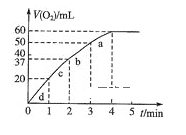
①实验中放出气体的总体积是 __________mL。
②H2O2的初始物质的量浓度是____________(保留2位有效数字)。
③a、d两段反应速率大小的顺序为_____>_____,原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
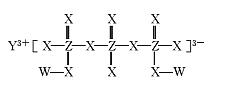
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:
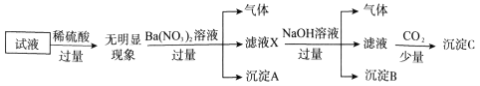
下列说法正确的是( )
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物化合物![]() 存在下列关系:
存在下列关系:
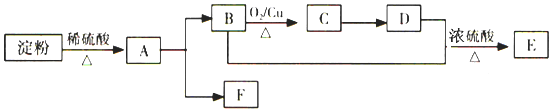
(1)写出D的官能团名称___。
(2)B+D→E的反应类型是___。
(3)反应B→C的化学方程式是___。
(4)糖类、油脂、蛋白质均为人类重要的营养物质,下列说法不正确的是:___。
A.化合物A与银氨溶液混合后,水浴加热生成银镜,说明A中存在醛基
B.油脂是高级脂肪酸和甘油形成的酯类高分子化合物,氨基酸分子中都存在氨基和羧基两种官能团
C.将绿豆大小的钠块投入B中,钠块沉在液面下,并有大量气泡产生
D.乙酸乙酯制备实验中用饱和碳酸钠溶液收集产物,乙酸乙酯在下层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备NaI的装置如图所示,基本步骤为:![]() 检查装置气密性;
检查装置气密性;![]() 关闭K,向B中滴入
关闭K,向B中滴入![]() 溶液,制得
溶液,制得![]() ;
;![]() 打开K,通入
打开K,通入![]() 至饱和制得NaI,同时有黄色沉淀产生;
至饱和制得NaI,同时有黄色沉淀产生;![]() 关闭K,向所得溶液加入稀硫酸,水浴加热,充分逸出
关闭K,向所得溶液加入稀硫酸,水浴加热,充分逸出![]() ;
;![]() 把B中混合液倒入烧杯,加入足量碳酸钡除去稀硫酸,再经过一系列操作得到NaI成品。下列有关叙述错误的是
把B中混合液倒入烧杯,加入足量碳酸钡除去稀硫酸,再经过一系列操作得到NaI成品。下列有关叙述错误的是
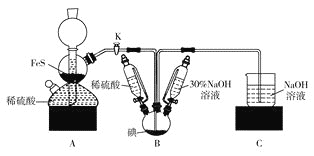
A.A中装置可随开随用、随关随停,制备气体原理为:![]()
B.制备NaI涉及以下两个反应:![]() 、
、![]()
C.装置B中的恒压分液漏斗可以平衡分液漏斗和三口烧瓶内压强,便于液体顺利流下
D.步骤![]() 中的“一系列操作”包括过滤、洗涤、合并滤液和洗液、蒸馏等操作
中的“一系列操作”包括过滤、洗涤、合并滤液和洗液、蒸馏等操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如图装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠(夹持装置和A中加热装置已略,气密性已检验)。
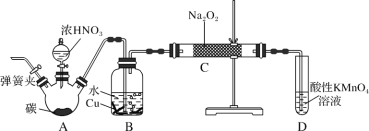
查阅资料:
①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成;
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)B中观察到的主要现象是_______,D装置的作用是_______。
(2)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。生成碳酸钠的化学方程式是_______。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是_______ (写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将已加热至恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
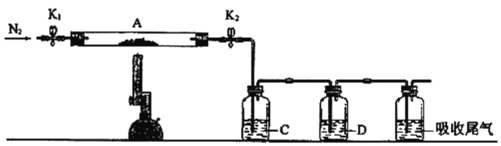
①C、D中的溶液依次为___、___(填标号)。C、D中有气泡冒出,并可观察到的现象分别为___。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com