
 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。
)。 )-c(NH
)-c(NH )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。 )>c(NH
)>c(NH )>c(OH-)=c(H+) (2分)
)>c(OH-)=c(H+) (2分)  )小于 0.1 mol·L-1NH4HSO4中c(NH
)小于 0.1 mol·L-1NH4HSO4中c(NH )。
)。 )-c(NH
)-c(NH )-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11
)-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11 )>c(NH
)>c(NH )>c(OH-)=c(H+)
)>c(OH-)=c(H+)

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:不详 题型:单选题
| A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.纯碱溶液去油污 | B.稀醋酸溶液加热时其pH 减小 |
| C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 | D.浓的硫化钠溶液有臭味 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H3O++Cl-
H3O++Cl- H2CO3+2NaOH
H2CO3+2NaOH NH3·D2O+H+
NH3·D2O+H+| A.①②③④ | B.①②③ |
| C.②③⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.W点所示的溶液中:c(Na+)+c(H+)=2c( )+c(OH-)+c(Cl-) )+c(OH-)+c(Cl-) |
B.pH=4的溶液中:c(H2CO3)+c(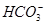 )+c( )+c( )<0.1 mol·L-1 )<0.1 mol·L-1 |
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(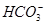 )=c(OH-)+c(Cl-) )=c(OH-)+c(Cl-) |
D.pH=11的溶液中:c(Na+)>c(Cl-)>c( )>c( )>c(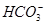 )>c(H2CO3) )>c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com