
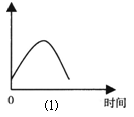
| A.①④ | B.③④ | C.①②③ | D.②③ |
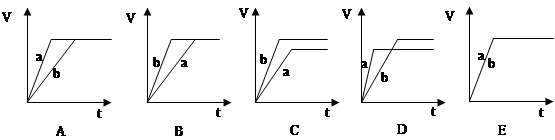


科目:高中化学 来源:不详 题型:单选题
| A.v(A)=0.1mol/(L?min) | B.v(B)=0.6mol/(L?min) |
| C.v(C)=0.5mol/(L?min) | D.v(D)=0.3mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加N2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 R(气)+2L此反应符合下面图象,下列叙述正确的是( )
R(气)+2L此反应符合下面图象,下列叙述正确的是( )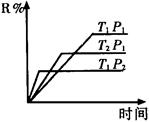
| A.正反应吸热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应放热,L是气体 |
| D.正反应放热,L是固体或液体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②①③ | C.③②① | D.①③② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锌与稀硫酸反应时,加少量铜粉 |
| B.Fe与稀硫酸反应制取H2时,改用98%浓硫酸 |
| C.Al在氧气中燃烧生成A12O3,将铝片改成铝粉 |
| D.恒温时,增大H2(g)+Br2(g) ?2HBr(g)反应体系的压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com