
锗及其化合物被广泛应用于半导体、催化剂等领域。以铅锌矿含锗烟尘为原料可制备GeO2,其工艺流程图如下。

已知:GeO2是两性氧化物;GeCl4易水解,沸点86.6℃
(1)第①步滤渣主要成分有_____________(填化学式),实验室萃取操作用到的玻璃仪器有__________________。
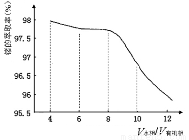
(2)第③步萃取时,锗的萃取率与V水相/V有机相(水相和有机相的体 积比)的关系如下图所示,从生产成本角度考虑,较适宜的V水相/V有机相的值为 。
(3)第④步加入盐酸的作用__________________________________(答两点即可),应控制温度的方法及范围____________________________。
(4)第⑤步反应的化学方程式_______________________________。
(5)二氧化锗可先用次亚磷酸钠还原为Ge2+,用淀粉溶液作指示剂,用c mol/L碘酸钾标准溶液滴定,消耗体积VmL,列出烟尘中锗的质量分数的计算式________。(有关反应式为:3Ge2++IO3-+6H+=3Ge4++I-+3H2O,IO3-+5I-+6H+=3I2+3H2O)。
科目:高中化学 来源:2015-2016学年山西省高一下第三次月考化学试卷(解析版) 题型:选择题
在一定温度下,容积不变的密闭容器中发生反应:C(s)+H2O(g) CO(g)+H2(g),下列叙述不能说明该可逆已经达到平衡状态是( )
CO(g)+H2(g),下列叙述不能说明该可逆已经达到平衡状态是( )
A. 混合气体压强不再发生变化
B. 混合气体质量不再发生变化
C. 反应中CO与H2的物质的量之比为1︰1
D. 生成n mol CO的同时生成n mol H2O(g)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:选择题
下列关于有机物的叙述中正确的是( )
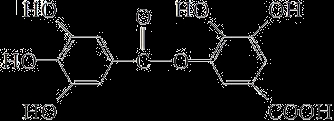
A.油脂在稀硫酸或氢氧化钠溶液中均可发生水解反应,水解产物相同
B.取淀粉与稀硫酸共热后的溶液,加入新制银氨溶液共热,没有银镜产生,说明淀粉尚未水解生成葡萄糖
C.结构式为如上图所示的有机物,可以在稀硫酸催化下发生水解反应,但水解产物只有一种
D.纤维素、蔗糖、葡萄糖、蛋白质在一定条件下均可发生水解
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:填空题
亚硝酸钠可大量用于染料和有机合成工业。请回答下列问题:
(1)亚硝酸钠能氧化酸性条件下的Fe2+,同时产生一种活性气体,该气体在空气中迅速变色。写出反应的离子方程式 。
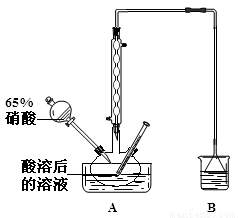
(2)实验室模拟用如图所示装置通过如下过程制备亚硝酸钠:
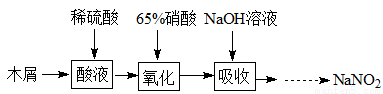
已知:(I)氧化过程中,控制反应液的温度在35~60℃条件下发生的主要反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
(II)氢氧化钠溶液吸收NO、NO2发生如下反应:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O
①A中反应温度不宜高于60℃,原因是 。
②不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH?外还有两种阴离子,其中一种是NO2?,NO2?与另一种阴离子的物质的量之比为 。
③B装置用于制备NaNO2,盛装的试剂除NaOH外,还可以是 。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3(aq)
(3)测定产品纯度:
I.准确称量ag产品配成100 mL溶液;
II.从步骤I配制的溶液中移取20.00 mL加入锥形瓶中;
III.用c mol·L?1酸性KMnO4溶液滴定至终点;
IV.重复以上操作3次,消耗KMnO4酸性溶液的平均体 积为V mL。
积为V mL。
①锥形瓶中发生反应的离子方程式为 。
②滴定至终点的现象为 。
③ 产品中NaNO2的纯度为 (写出计算表达式)。
产品中NaNO2的纯度为 (写出计算表达式)。
④若滴定终点时俯视读数,则测得的产品中NaNO2的纯度 (填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三押题卷理综化学试卷(解析版) 题型:选择题
为建设“蓝天常在、青山常在、绿水常在”的美丽中国,2015年4月16日国务院颁布了《水污染防治行动计划》。下列做法有利于该目标实现的是( )
A.推广使用含磷洗涤剂
B.用O3替代Cl2作饮用水消毒剂
C.用工业污水直接灌溉农田
D.含H2SO4的废水用BaCl2处理后排放
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,W的最内层电子数是最外层的1/3,ZX2是一种储氢材料,W与Y属于同一主族。下列叙述不正确的是
A.原子半径: rY < rW < rZ
B.Y形成的离子与W形成的离子的电子数可能相同
C.化合物ZY、WY3中化学键的类型相同
D.由X、Y、Z、W组成的化合物的水溶液可能显酸性
查看答案和解析>>
科目:高中化学 来源:2016届福建厦门外国语学校高三5月月考理综化学试卷(解析版) 题型:填空题
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)砷的氢化物的化学式为________,其稳定性比磷的氢化物____(填“强或弱”)。已知H3AsO3是两性偏酸性的化合物,它与硫酸反应的化学方程式为 。NaHAsO3溶液呈碱性,该溶液中c(H2AsO3-) C(AsO33-)(填“>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷的过程是:先在空气中煅烧使其转化为砒霜(As2O3),然后用焦炭还原。写出焦炭还原时发生反应的化学方程式: 。砒霜有剧毒,卫生防疫分析中鉴定的方法是:先将试样与锌、硫酸混合在一起反应,将生成的气体导入到热玻璃管中热解,若玻璃管中产生亮黑色的“砷镜”,则说明试样中含有As2O3。写出上述鉴定过程中有关反应的化学方式: 。
②“砷镜”可被漂白精氧化为H3AsO4,反应中还原剂与氧化剂物质的量之比为 。
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性。
①常温下砷酸的K1=6×10-3、K2=1×10-7,则NaH2AsO4溶液的pH为____7。(填“>”、“<”、“=”),判断依据为___________________________________________________________________。
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O AsO33-+I2+2OH-。
AsO33-+I2+2OH-。

当P池中溶液由无色变成蓝色时,正极上的电极反应式为 。当电流计指针归中后向Q池中加入一定量的NaOH,则电池负极所在的烧杯为 (填“P”或“Q”)。
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高三最后一卷理综化学试卷(解析版) 题型:选择题
近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是
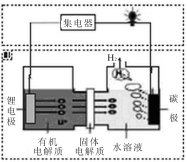
A.碳极发生的反应是:2H2O+2e-=H2↑+2OH -
B.有机电解质和水溶液不可以互换区域
C.标况下产生22.4L的氢气时,正极消耗锂的质量为14g
D.该装置不仅可提供电能,还可得到清洁的氢气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一6月学业调研化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是
A.将Cl2通入氯化亚铁溶液:Fe2++Cl2=Fe3++2Cl-
B.氯气通入水中:Cl2+H2O=2H++Cl-+ClO-
C.向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O
D.往水玻璃中通入少量二氧化碳:SiO32-+H2O+CO2=H2SiO3↓+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com