
【题目】德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:
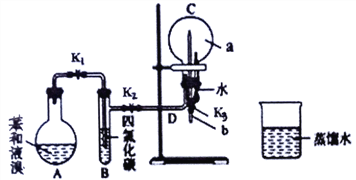
实验操作:
①按上图所示的装置图连接好各仪器;②检验装置的气密性;
③在A 中加入适量的苯和液溴的混合液体,再加入少量_______________,塞上橡皮塞,打开K1、K2止水夹,关闭K3止水夹;
④待烧瓶C中气体收集满后,将导管b的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题:
(1)写出A中反应的化学方程式:________________________________。
(2)③再加入少量____________在实验过程中观察到装置A 中有微沸现象,原因是_____________________________。
(3)当C中观察到_____________________________,可证明凯库勒观点是错误的,以下可证明凯库勒观点错误的事实是______________________________________。
①6个C-H 键的长度相等 ②6个碳碳键的长度都相等
③苯的一氧代物只有一种结构 ④苯的邻二氧代物只有一种结构
⑤苯不能使酸性高锰酸钾溶液褪色 ⑥苯不能使溴的四氧化碳溶液因加成而褪色
A. ①②⑤⑥ B. ②④⑤⑥ C.全部 D. ①②③④⑤
(4)将装置A 内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯:
①用蒸馏水洗涤,振荡,分液;②用5%的NaOH 溶液洗涤,振荡,分液;③用蒸馏水洗涤,振荡,分液;④加入无水氯化钙干燥;⑤____________________ (填操作名称)。
【答案】 ![]() 铁粉 反应放热 产生喷泉现象 B 蒸馏
铁粉 反应放热 产生喷泉现象 B 蒸馏
【解析】(1)苯与液溴在催化剂的作用下可发生取代反应,反应的化学方程式:![]() ,答案为:
,答案为:![]()
(2)在A 中加入适量的苯和液溴的混合液体,再加入少量铁粉,可以观察到装置A 中有微沸现象,原因是苯与液溴的反应是放热反应,答案为:铁粉 ;反应放热
(3)苯与溴如果发生加成反应,不会产生溴化氢,不会发生喷泉实验;如果发生取代反应,则生成溴化氢,溴化氢易溶于水,能够发生喷泉实验,所以只要发生喷泉实验,则证明苯与溴发生的是取代而不是加成反应,证明不含双键,可以证明凯库勒观点错误;①6个C-H键的长度相等,无法说明是否存在单、双键,故①错误;②6个碳碳键的长度都相等,说明不存在单、双键,故②正确;③苯的一氯代物只有一种结构,无法说明是否存在单、双键,故③错误;④苯的邻二氯代物只有一种结构,说明不存在单、双键,故④正确;⑤苯不能使酸性高锰酸钾溶液褪色,说明不存在单、双键,故⑤正确;⑥苯不能使溴的四氯化碳溶液因加成而褪色,说明不存在单、双键,故⑥正确;故答案为B;答案为:产生喷泉现象; B
(4)经过①至④后得到苯和溴苯的混合液,可利用沸点差异通过蒸馏进行分离。答案为:蒸馏


科目:高中化学 来源: 题型:
【题目】H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是( ) 
A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属、卤素结构和性质描述正确的是
①随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高,密度依次增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物R2O
④根据同族元素性质的递变规律推测At 与H化合较难,砹化银也难溶于水且具有感光性。
⑤根据F、Cl、Br、I的非金属性递减,可推出HF、HCl、HBr、HI的还原性、水溶液酸性均依次增强而热稳定性依次减弱。
⑥碱金属都应保存在煤油中
⑦卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大起主要作用
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳
A. ④⑦⑧ B. 全部正确 C. ⑤⑥⑦ D. ①③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g)p C(g)△H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( ) 
A.T1<T2 , P1>P2 , m+n>p,△H<0
B.T1>T2 , P1<P2 , m+n>p,△H>0
C.T1<T2 , P1>P2 , m+n<p,△H<0
D.T1>T2 , P1<P2 , m+n<p,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为:r(y)>r(x)>r(z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是

A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸点高于C的沸点
D. A和C不可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.放电时负极附近溶液的碱性不变
B.充电过程是化学能转化为电能的过程
C.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
D.放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

相关离子生成氢氧化物的pH 和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)调节pH 步骤中,溶液pH的调节范围是________。
(2)滤渣1和滤渣3 主要成分的化学式分别是________、________。
(3)写出氧化步骤中加入H2O2 发生反应的离子方程式________。
(4)酸浸过程中,1molNiS失去6 NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式________。
(5)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为________g。(保留小数点后1位有效数字)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com