
【题目】某酸式盐NaHY的水溶液显碱性,下列叙述正确的是![]()
![]()
A.![]() 的电离方程式:
的电离方程式:![]()
B.![]() 的水解方程式:
的水解方程式:![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
【答案】C
【解析】
A.![]() 是二元弱酸,电离时分两步电离,第一步电离生成氢离子和酸式酸根离子,电离方程式为:
是二元弱酸,电离时分两步电离,第一步电离生成氢离子和酸式酸根离子,电离方程式为:![]()
![]()
![]() ,故A错误;
,故A错误;
B.![]() 离子水解生成
离子水解生成![]() ,所以
,所以![]() 离子水解的离子方程式为:
离子水解的离子方程式为:![]()
![]()
![]() ,故B错误;
,故B错误;
C.某酸式盐NaHY的水溶液显碱性,阴离子水解,钠离子不水解,所以![]() ;
;![]() 的电离程度小于
的电离程度小于![]() 的水解程度,所以
的水解程度,所以![]() ,但无论电离还是水解都较弱,阴离子还是以
,但无论电离还是水解都较弱,阴离子还是以![]() 为主,溶液呈碱性,说明溶液中
为主,溶液呈碱性,说明溶液中![]() ;所以离子浓度大小顺序为
;所以离子浓度大小顺序为![]() ,故C正确;
,故C正确;
D.某酸的酸式盐NaHY的水溶液中,阴离子水解,钠离子不水解,所以![]() ;
;![]() 的电离程度小于
的电离程度小于![]() 的水解程度,所以
的水解程度,所以![]() ,但无论电离还是水解都较弱,阴离子还是以
,但无论电离还是水解都较弱,阴离子还是以![]() 为主,溶液呈碱性,说明溶液中
为主,溶液呈碱性,说明溶液中![]() ;因溶液中还存在水的电离,则
;因溶液中还存在水的电离,则![]() ,所以离子浓度大小顺序为
,所以离子浓度大小顺序为![]() ,故D错误。
,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】下列有关化学及人类社会发展历程的说法中,不正确的是![]()
![]()
A.道尔顿的“原子论”和阿伏加德罗的“分子学说”对化学的发展起到了极大的推动作用
B.门捷列夫将元素按原子序数由小到大的顺序依次排列,制出了第一张元素周期表
C.享有“镇国之宝”称谓的“后母戊鼎”属于青铜制品
D.![]() 本草纲目
本草纲目![]() 中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是
中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、G的原子序数依次增大,在元素周期表中A的原子半径最小(稀有气体元素除外),B与C相邻且C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与G的最外层电子数相等,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置是__________;由C和D组成既含离子键又含共价键的化合物的电子式__________。
(2)分别由C、D、E、G元素形成的简单离子的半径由大到小的顺序为__________(用相应的离子符号表示)。
(3)写出实验室中制备G元素的单质的离子方程式______________________________
(4)E单质能写D的最高价氧化物的水化物浓溶液反应放出氢气,反应的离子方程式是:__________由上述六种元素中的三种组成的某种盐,是漂白液的主要成分,将该盐溶液滴入硫酸酸化的KI淀粉溶液中,溶液变为蓝色,则反应的化学方程式为________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基:![]() +3Fe+6HCl→
+3Fe+6HCl→![]() +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
已知:—CH3为邻、对位取代定位基;而—COOH为间位取代定位基
A.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
B.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
C.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
D.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列诗句、谚语或与化学现象有关,说法不正确的是
A. “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
B. “落汤螃蟹着红袍”肯定发生了化学变化
C. “滴水石穿、绳锯木断”不包含化学变化
D. “看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s)-Q,一段时间后,达到化学平衡状态.下列叙述正确的是
Z(g)+W(s)-Q,一段时间后,达到化学平衡状态.下列叙述正确的是
A.加入少量W,逆反应速率增大
B.通入一定量氦气,压强增大,平衡向正反应方向移动
C.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
D.降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置对应内容不能完成实验目的是( )
A.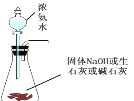 实验室用来快速制取少量氨气的发生装置
实验室用来快速制取少量氨气的发生装置
B.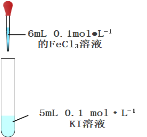 用来探究氯化铁和碘化钾反应限度,反应结束后,加硫氰化钾溶液检测铁离子
用来探究氯化铁和碘化钾反应限度,反应结束后,加硫氰化钾溶液检测铁离子
C.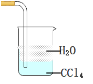 实验室用来吸收尾气氨气的装置
实验室用来吸收尾气氨气的装置
D.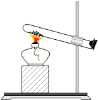 实验室用来制取少量氧气的发生装置,试管内装有氯酸钾和二氧化锰
实验室用来制取少量氧气的发生装置,试管内装有氯酸钾和二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7。主要流程如图:
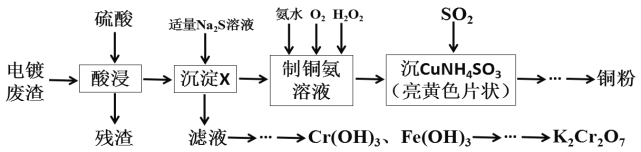
(1)加入适量Na2S溶液后生成的沉淀X为___,若加入的Na2S溶液过量,除生成X外还会发生反应的离子方程式为___。
(2)请配平[Cu(NH3)4]SO4·H2O加热发生分解反应的化学方程式。
___[Cu(NH3)4]SO4·H2O![]() ___Cu+___NH3↑+___SO2↑+___N2↑+___H2O
___Cu+___NH3↑+___SO2↑+___N2↑+___H2O
(3)“沉CuNH4SO3”时可用如图装置(夹持、加热仪器略):
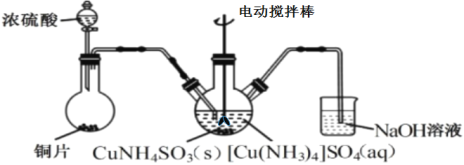
①“沉CuNH4SO3”时,反应温度需控制在45℃,合适的加热方式是___。
②NaOH溶液的作用是___。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.0g配成250mL溶液,取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol/L硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行三次实验。(已知Cr2O72-被还原为Cr3+)
①若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为20.00mL,则所得产品K2Cr2O7的纯度为___%。
②上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+,还含有一定浓度的Fe3+,可通过调pH的方法使两者转化为沉淀。假设两种离子初始浓度均为2×10-3mo/L,当溶液中刚开始析出Cr(OH)3沉淀时,c(Fe3+)=___mo/L。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com