
下列各离子浓度的大小比较,正确的是()
A. 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④
B. 常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl﹣)
C. 0.2 mol•L﹣1Na2CO3溶液中:c (OH﹣)=c (HCO3﹣)+c (H+)+c (H2CO3)
D. 0.01 mol•L﹣1的NH4Cl溶液与0.05mol•L﹣1的NaOH溶液等体积混合:c (Cl﹣)>c (NH4+)>c (Na+)>c (OH﹣)>c (H+)
考点: 离子浓度大小的比较;盐类水解的应用.
专题: 盐类的水解专题.
分析: A.等浓度的溶液中,铵根离子浓度与其系数成正比,当铵根离子系数相同时,根据其水解程度判断;
B.根据电荷守恒判断;
C.根据质子守恒判断;
D.二者混合后,根据物料守恒分析.
解答: 解:A.等浓度的溶液中,铵根离子浓度与其系数成正比,当铵根离子系数相同时,根据其水解程度判断,所以铵根离子浓度最大的是硫酸铵,碳酸氢铵和氯化铵中铵根离子系数相同,但铵根离子和碳酸氢根离子相互促进水解,所以氯化铵中铵根离子浓度大于碳酸氢铵,一水合氨是弱电解质,其电离程度很小,所以铵根离子浓度最小,故A正确;
B.溶液呈中性,则氢离子浓度等于氢氧根离子浓度,根据电荷守恒知c (NH4+)=c (Cl﹣),故B错误;
C.根据质子守恒知,c (OH﹣)=c (HCO3﹣)+c (H+)+2c(H2CO3),故C错误;
D.二者混合后,根据物料守恒知,c (Na+)>c (Cl﹣),故D错误;
故选A.
点评: 本题考查了离子浓度大小的比较,根据电荷守恒、质子守恒、物料守恒来分析解答,难度中等.


科目:高中化学 来源: 题型:
下列能用勒沙特列原理解释的是()
①红棕色NO2加压后颜色先变深后变浅
②SO2催化氧化成SO3的反应,往往加入过量的空气
③Fe(SCN)3溶液中加入固体KSCN后颜色变深
④氯水宜保存在低温、避光条件下
⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利.
A. ①②⑤ B. ②③④ C. ①②③⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实均能说明醋酸是弱电解质的是()
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol/L醋酸溶液的pH比0.1mol/L盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢.
A. ②③⑥ B. ④⑤⑥ C. ③④⑥ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是()
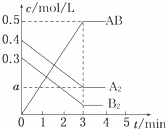
A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是某课题组设计的由烃A合成聚酯类高分子材料.
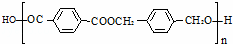 的路线:
的路线:
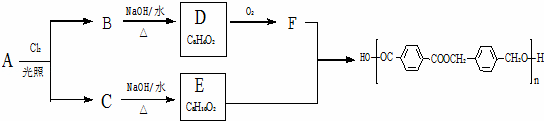
已知同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮.
根据以上信息回答:
(1)A的分子式 ,F中官能团的名称是 .
(2)化合物D的结构简式是 ,由B生成D的反应过程中生成的不稳定中间体的结构简式是 ,该中间体生成D的反应类型为 .
(3)E与F反应的化学方程式是 ,反应类型为 .与E具有相同官能团的含苯环的同分异构体有(写结构简式) 、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,取一定质量的硫酸铜溶液,用石墨做电极进行电解,当阳极产生标况下气体1.12L时,CuSO4恰好被完全电解,得到密度为1.2g•cm﹣3的溶液200mL.求:
(1)电解后所得溶液的为 .
(2)电解前所取CuSO4溶液的质量为 g.
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入何种物质(只要求写出一种),其化学式为CuO,加入物质的质量为 g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com