
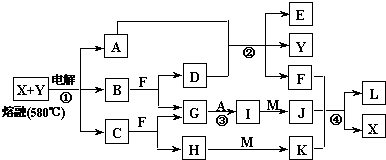
������֮���ת����ϵ����ͼ��ͼ�в���������ʡ�ԣ��������Ϣ���£�
��XΪ���ɫ��������AΪ���ʣ�BΪ��Һ��D��FΪ���壻�۷�ӦI�IJ���ֻ��Y��H O��
O��
��B��D��F��Y�о�����ͬһԪ�ء�

��ش��������⣺
��1�����A��Ԫ�������ڱ������� ��ѡ����ţ���
A������Ԫ�� B������Ԫ�� C��������Ԫ�� D������Ԫ��
��2��д����ҺB�����ʵĻ�ѧʽ�� ��
��3��д����ӦI�Ļ�ѧ��Ӧ����ʽ�� ��
��4����ʯīΪ�������ϣ����C�ĵ�ˮ��Һ��д�������������ĵ缫��Ӧʽ�� ��
��5��28g����A��һ��Ũ�ȵ�B��Һ��Ӧ��������n(C):n(E)=2:3ʱ����Ӧ��ת�Ƶ��� mol.
��6����E��Һ�м��� Ҳ������X��д����n(E):n(
Ҳ������X��д����n(E):n( )=1:1ʱ����Ӧ�����ӷ���ʽ
��
)=1:1ʱ����Ӧ�����ӷ���ʽ
��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

 ]2-Na+
]2-Na+ ]2-Na+
]2-Na+
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ����
��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

 ]2-Na+
]2-Na+ ]2-Na+
]2-Na+
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com