
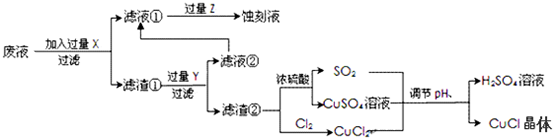
分析 要利用制作印刷电路的废液制备氯化亚铜,首先应制备并分离出铜,向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)工业生产硫酸的方法为接触法制硫酸,氯碱工业的装置是离子交换膜电解槽;
(2)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜;过滤后滤渣中含有铜和铁,依据铜和铁的活泼性,加入盐酸分离二者;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,依据得失电子守恒配平方程式;
(4)抽滤或者减压过滤可以快速过滤,CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,乙醇洗涤可以减少CuCl的损失,生产过程中调节溶液的pH不能过大是防止其水解生成沉淀;
(5)依据图示可知:铜与浓硫酸反应生成硫酸铜、二氧化硫的物质的量之比为1:1,而产生CuCl的化学方程式中硫酸铜、二氧化硫物质的量之比恰好为:1:1;
(6)依据氯化亚铜具有还原性,易被氧化而变质,具有见光分解的性质解答.
解答 解:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)工业生产硫酸的方法名称是接触室,氯碱工业的装置是离子交换膜电解槽,
故答案为:接触室,离子交换膜电解槽;
(2)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来,
故答案为:Fe;HCl;
(3)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,产生CuCl的化学方程式依据得失电子守恒得到:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4,
故答案为:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解;
故答案为:抽滤或者减压过滤,减少CuCl的损失,防止CuCl水解;
(5)依据图示可知:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体;
(6)氯化亚铜具有还原性,易被氧化而变质,具有见光分解,所以生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失,
故答案为:防止CuCl的氧化和见光分解.
点评 本题为工艺流程题,为高考热点和难点,设计物质的分离、物质的制备,明确物质的性质是解题关键,注意物质性质的理解应用,题目难度较大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
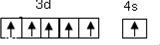
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | O2->Na+ | CaO<MgO | HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
把4 mol A气体和4 mol B气体混合放入2 L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g) 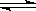 C(g)+2D(g);经5min达到平衡, 测得压强减小了10%,下列说法中正确的是
C(g)+2D(g);经5min达到平衡, 测得压强减小了10%,下列说法中正确的是
A.平衡体系中C的体积分数为1/9
B.平衡时A的浓度为2.4mol/L
C.D的平均速率为0.32mol/(L·min)
D.B的转化率为20%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CO(g)+ O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
现有CO、H2和CO2组成的混合气体112.0 L(标准状况)完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为
A.80% B.40% C.60% D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
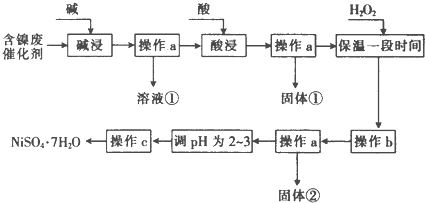
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的相对分子质量相同,互称同分异构体 | |
| B. | 糖类、油脂、蛋白质都属于天然高分子化合物 | |
| C. | 油脂在酸性条件下和碱性条件下都可以水解,且水解产物均相同 | |
| D. | 在允许加热的条件下,可以用氢氧化铜鉴别葡萄糖、乙酸、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯中 | B. | 乙酸中 | ||
| C. | 水中 | D. | 乙酸、乙酸乙酯和水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com