
| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和NO2(g)的生成速率相同 | D. | SO3(g)和NO(g)的浓度比为1:1 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、反应前后气体系数和相等,体系总压强始终是不变的,所以总压强不随时间而改变的状态不一定是平衡状态,故A错误;
B、反应前后都是气体,体系气体总质量始终是不变的,体系总质量不再随时间而改变的状态不一定是平衡状态,故B错误;
C、NO(g)和NO2(g)的生成速率相同,说明正逆反应速率相等,状态一定是平衡状态,故C正确;
D、SO3(g)和NO(g)的浓度比为1:1,不能表明正逆反应速率相等,状态不一定是平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:解答题
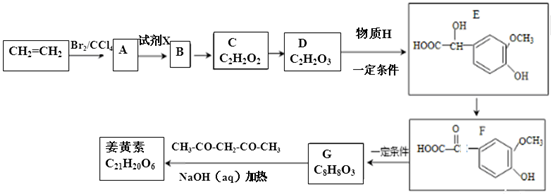
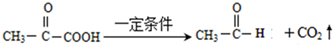
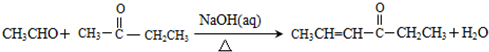
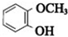 .
. .
.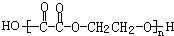 +(2n-1)H2O.
+(2n-1)H2O.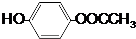 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>H3AsO4>H3PO4 | |
| B. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | |
| C. | 金属单质置换出氢的能力:Cs>Rb>K>Ca | |
| D. | 氧化性:F2>Cl2>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M g | B. | $\frac{1}{M}$g | C. | $\frac{6.02×1{0}^{23}}{M}$g | D. | $\frac{M}{{N}_{A}}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期零族 | B. | 第四周期第IIA族 | C. | 第三周期第ⅠA族 | D. | 第三周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸在常温下能够使铁、铝等金属表面形成氧化膜而钝化 | |
| B. | 浓硫酸在常温下可迅速与碳反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气、硫化氢等气体 | |
| D. | 浓硫酸具有吸水性,因而能使蔗糖炭化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
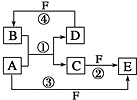 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com