
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:Na+2H2O═Na++2OH﹣+H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D. 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知反应:2SO2(g) + O2(g)![]() 2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =___________ mol·L-1·min-1。
2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =___________ mol·L-1·min-1。
(2)已知:2SO2(g) + O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的 △H=___________kJ·mol-1。
SO3(g)+NO(g)的 △H=___________kJ·mol-1。
(3)一定温度下,将NO2与SO2以体积比1∶2 置于容积固定的密闭容器中发生(2)中反应,下列事实能说明反应达到化学平衡状态的是___________(填正确选项字母编号)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2和SO2的体积比保持不变 d.△H保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在mA+nB===pC的反应中,m、n、p为各物质的系数,现测得C每分钟增加a mol·L-1,B每分钟减少1.5a mol·L-1,A每分钟减少0.5a mol·L-1,则m∶n∶p为
A.2∶3∶2 B.2∶2∶3
C.1∶3∶2 D.3∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班在实验室进行制取乙酸乙酯的分组实验,主要步骤如下:
①按下图连接好装置,并检查装置的气密性。

②在试管A中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸,再加入沸石。然后用酒精灯缓慢加热.
③待试管B中收集到一定量产物后停止加热,撤出试管B,振荡后静置。
相对分子质量 | 密度/(gcm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
乙醇 | 46 | 0.789 | -117.3 | 78.5 | 以任意比互溶 |
乙酸 | 60 | 1.050 | 16.6 | 117.9 | 易溶 |
乙酸乙酯 | 88 | 0.897 | -84 | 77 | 难溶 |
回答下列问题:
(1)反应的化学方程式为______________。
(2)两组同学想要比较所制得的乙酸乙酯的产量,简便的方法是__________。
(3)该反应为可逆反应,要提高乙酸乙酯的产率,该实验中采取的措施有_________。
(4)现对全班同学试管B中的液体集中处理,得到乙酸乙酯的粗产品并回收乙醇,需进行的操作名称是__________。
(5)用下图所示装置验证:乙酸的酸性比碳酸强,碳酸的酸性比苯酚强。
装置中所装的药品分别是:甲_________,乙________,丙____________。试管中观察到的现象是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
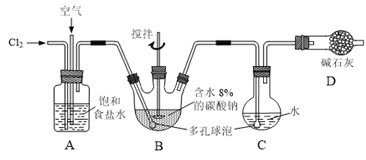
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅱ]丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+![]() O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=242 kJ·mol1
O2(g)= H2O(g) ΔH3=242 kJ·mol1
反应①的ΔH1为________kJ·mol1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
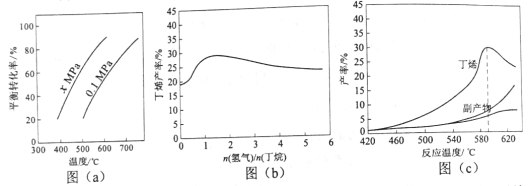
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是__________________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅰ节选]近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2
与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率![]() =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率![]() _____
_____![]() ,该反应的
,该反应的![]() H_____0。(填“>”“<”或“=”)
H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com