
| A. | 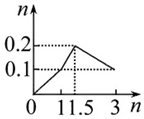 向1 L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合液中加入0.1 mol•L-1稀硫酸 | |
| B. |  向1 L含有0.1 mol•L-1 AlCl3和0.3 mol•L-1 NH4Cl的混合液中加入0.1 mol•L-1 NaOH溶液 | |
| C. |  向烧碱溶液滴加明矾溶液 | |
| D. | 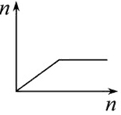 向AlCl3溶液滴加过量氨水 |
分析 A.向Ba(OH)2、NaAlO2混合溶液中加稀H2SO4,开始生成硫酸钡沉淀和氢氧化铝沉淀,硫酸过量时氢氧化铝溶解;
B.氢氧化铝与氢氧化钠反应时,二者物质的量比为1:1;
C.铝离子与过量的氢氧根离子反应生成偏铝酸根离子,偏铝酸根离子与铝离子反应生成氢氧化铝沉淀;
D.氢氧化铝不溶于氨水.
解答 解:A.向1L浓度均为0.1 mol•L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol•L-1的稀H2SO4,0.1molBa(OH)2消耗0.1mol硫酸,0.1molNaAlO2消耗0.05mol硫酸,硫酸过量时氢氧化铝溶解,0.1mol氢氧化铝消耗硫酸0.15mol,故A正确;
B.向1L浓度分别为0.1 mol•L-1和0.3 mol•L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol•L-1的稀NaOH溶液,AlCl3与NaOH反应生成沉淀,然后氢氧化钠与氯化铵反应生成氨水,最后氢氧化铝与氢氧化钠反应,沉淀溶解,此时氢氧化铝与氢氧化钠的物质的量比为1:1,图象符合,故B正确;
C.铝离子与过量的氢氧根离子反应生成偏铝酸根离子,偏铝酸根离子与铝离子反应生成氢氧化铝沉淀,偏铝酸根离子的物质的量是铝离子的$\frac{1}{3}$,图象不符合,故C错误;
D.向AlCl3溶液中滴加过量氨水,开始产生氢氧化铝沉淀,氨水过量时,沉淀不溶解,氢氧化铝不溶于氨水,图象符合,故D正确.
故选C.
点评 本题考查了混合物反应的计算与应用,题目难度中等,明确发生反应的实质为反应的先后顺序为解答关键,试题充分培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.
,其分子中含(填“含”或“不含”)σ键,不含(填“含”或“不含”)π键.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
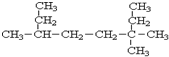 3,3,6-三甲基辛烷
3,3,6-三甲基辛烷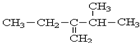 3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯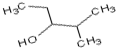 2-甲基-3-戊醇.
2-甲基-3-戊醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、干冰、纯碱 | B. | 硝酸、二氧化硫、苛性钠 | ||
| C. | 盐酸、氧化铜、熟石灰 | D. | 醋酸、水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
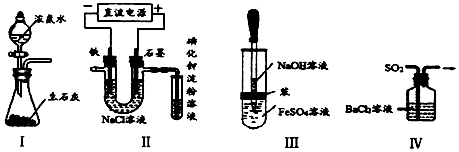
| A. | 实验Ⅰ:所示装置可制备氨气 | |
| B. | 实验Ⅱ:检验电解饱和食盐水的产物C12 | |
| C. | 实验Ⅲ:制取并观察Fe(OH)2沉淀 | |
| D. | 实验Ⅳ:吸收SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com