
| A、强电解质溶液的导电性一定比弱电解质溶液的导电性强 |
| B、醋酸溶液中存在两种共价化合物分子 |
| C、将FeCl3溶液加热蒸干,可得到FeCl3固体 |
| D、0.10 mol/L Al2(SO4)3溶液中Al3+数小于0.2NA (NA代表阿伏加德罗常数) |


科目:高中化学 来源: 题型:
A、 用此图装置制取并收集干燥纯净的NH3 |
B、 用此图装置实验室制备Fe(OH)2 |
C、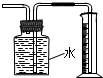 此图装置收集并测量Cu与浓硝酸反应产生的气体及体积 |
D、 此图装置可用于实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、SO42-、HCO3- |
| B、Cu2+、K+、SO42-、NO3- |
| C、Na+、K+、Cl-、SO42- |
| D、Fe2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“雾霾天气…光化学烟雾”的形成都与汽车排放的不合格尾气有关 |
| B、葡萄糖中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
| C、“辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料 |
| D、页岩气是从页岩层中开采出来的天然气.产气页岩分布广、厚度大,且普遍含气,故可以成为提供廉价而充足的新型燃料来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B位于元素周期表中第二周期第 VIA族 |
| B、工业上常用电解法制备C、D、E的单质 |
| C、B、D的最高价氧化物对应的水化物之间能发生化学反应 |
| D、化合物AE与CE具有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合物AE与CE含有相同类型的化学键 |
| B、元素C的化合物可以用来做焰火材料 |
| C、工业上常用电解法制备元素C、D、E的单质 |
| D、元素C、D的最高价氧化物对应的水化物之间可能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com