


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.2NaW+Z2=2NaZ+W2 | B.2NaX+Z2=2NaZ+X2 |
| C.2NaY+W2=2NaW+Y2 | D.2NaZ+X2=2NaX+Z2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向NH4HCO3溶液中加过量Ca(OH)2溶液:HCO3-+OH-+Ca2+=CaCO3↓+H2O |
B.用惰性电极MgCl2电解水溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
C.向偏铝酸钠溶液中加入少量硫酸氢钠溶液:2AlO2 +H +H +H2O=Al(OH)3↓ +H2O=Al(OH)3↓ |
D.浓盐酸跟二氧化锰混合共热:MnO2+4H +4Cl +4Cl =Mn =Mn +2H2O+2Cl2↑ +2H2O+2Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.x=2 | B.氧化产物和还原产物的比为2:5 |
| C.生成4mol H2O转移10mol电子 | D.MOyx-中的M的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时: 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—= CO32— +H2O |
| B.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好沉淀完全 NH4++Al3++2SO42—+2Ba2++4OH—= NH3·H2O+Al(OH)3↓+2BaSO4↓ |
| C.FeCl3溶液腐蚀铜线路板:Fe3++Cu = Fe2++Cu2+ |
| D.向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3—+OH—= CO32—+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .
2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是 ,不含离子键的化合物是 .查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 时,亚磷酸(
时,亚磷酸( ,二元酸)的
,二元酸)的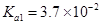 ,
, ;
; )的
)的 ,
,
| A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
B. |
C. |
D. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com