
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
科目:高中化学 来源:2014高考名师推荐化学金属矿物、海水、煤、石油、天然气开发利用(解析版) 题型:选择题
下列对相应有机物的描述完全正确的是
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④油脂:属于高分子化合物,可以发生水解反应
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥蛋白质:水解的最终产物为氨基酸,遇浓硝酸显黄色
A.①②③ B.②④⑥ C.①⑤⑥ D.①②⑥
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为 。Si与O的原子数之比为 化学式为 。
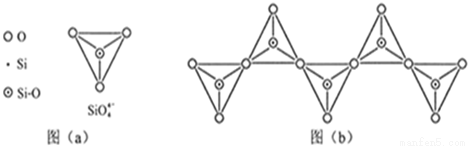
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
环境与可持续发展是现在国际的主题,利用海水是可持续发展的一个任务,对于海水的利用认识错误的是
A.海水中有大量人类需要的物质,人类可以大量开发海水中的物质,以满足资源短缺的问题
B.海水可以成为廉价的能源基地,但不能开发过度,要适度使用和开发
C.可以用太阳能电解海水以获取氢能源
D.人类在利用海水时要兼顾海洋生物和海洋生态平衡
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:选择题
有一无色溶液,可能含有K+、Al3+、Mg2+、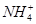 、Cl-、
、Cl-、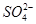 、
、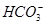 、
、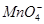 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
A.肯定有Al3+、Mg2+、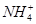 、Cl-
、Cl-
B.肯定有Al3+、Mg2+、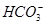
C.肯定有K+、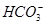 、
、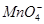
D.肯定有Al3+、Mg2+、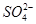
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:选择题
某溶液中含有NO、 、
、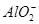 、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
A.只有S2- B.S2-和NO3-
C. 、S2-和NO3- D.4种离子都减少
、S2-和NO3- D.4种离子都减少
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式正误判断(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.用KIO3 氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4++OH- NH3↑+H2O
NH3↑+H2O
C.将过量SO2通入冷氨水中: SO2+NH3·H2O =HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜: Ag+2H++NO3-=Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
某研究小组在实验室用重晶石(主要成分BaSO4)对工业生产BaS进行模拟实验。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知:
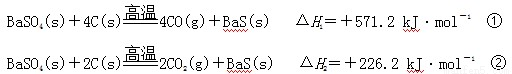
下列说法不正确的是
A.上述反应中BaSO4均作氧化剂
B.反应C(g)+CO2(g) 2CO(g)的ΔH3>+172.5 kJ·mol-1
2CO(g)的ΔH3>+172.5 kJ·mol-1
C.实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温
D. 以BaS作为沉淀剂,用于铅和汞沉淀的转化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)
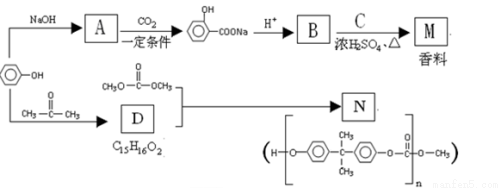
(1)B的官能团名称_____________。苯酚与浓溴水反应生成白色沉淀,可用于苯酚的定性检验和定量测定,反应的化学方程式为 。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C分子中有3中不同化学环境的氢原子,则M的结构简式为 。
(3)生成N的反应的化学方程式 ,反应类为 。
(4)以苯酚为基础原料也可以合成防腐剂F,已知F的相对分子质量为152,其中氧元素的质量分数为31.58%,F完全燃烧只生成CO2和H2O,则F的分子式是 ;
已知F具有如下结构特征:
①分子结构中含有苯环,能与NaHCO3溶液反应,但不能发生水解反应;
②分子结构中不存在“-O-O-”的连接方式。
符合上述条件的F的同分异构体有 种,其中核磁共振氢谱显示其分子中含有4种不同的氢原子的是 (写结构简式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com