
| A. | 1molOH-的质量为17g•mol-1 | |
| B. | 0.5mol H2所占体积约为11.2L | |
| C. | 等质量的金刚石和晶体硅所含原子个数之比为7:3 | |
| D. | 1mol NaCl固体溶于0.5L水中,所得溶液的物质的量浓度为2mol•L-1 |
分析 A.氢氧根离子的摩尔质量为17g/mol,质量的单位为g;
B.没有指出标准状况下,无法计算氢气的体积;
C.金刚石的主要成分为C,根据n=$\frac{m}{M}$计算等质量的二者的物质的量,然后可计算出含有原子数之比;
D.所得溶液的体积不是0.5L,溶液浓度不是2mol/L.
解答 解:A.1mol氢氧根离子的质量为:17g/mol×1mol=17g,故A错误;
B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.根据n=$\frac{m}{M}$可知,质量相等时,二者物质的量之比与摩尔质量成反比,则金刚石中C原子与硅原子的物质的量之比与摩尔质量成反比,二者物质的量之比=28g/mol:12g/mol=7:3,则二者含有原子的数目之比=原子的物质的量之比=7:3,故C正确;
D.1mol NaCl固体溶于0.5L水中,所得溶液的体积不是0.5L,无法计算溶液浓度,故D错误;
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度、气体摩尔体积、阿伏伽德罗常数等之间的关系,试题有利于提高学生的化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
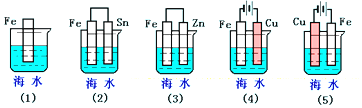
| A. | (5)(2)(1)(3)(4) | B. | (2)(5)(3)(4)(1) | C. | (5)(3)(4)(1)(2) | D. | (1)(5)(3)(4)(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水能导电,属于电解质 | |
| B. | 使品红溶液褪色,有漂白性 | |
| C. | 使酸性高锰酸钾溶液褪色,有还原性 | |
| D. | 能杀菌、消毒,可按照国家标准用作食物的防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
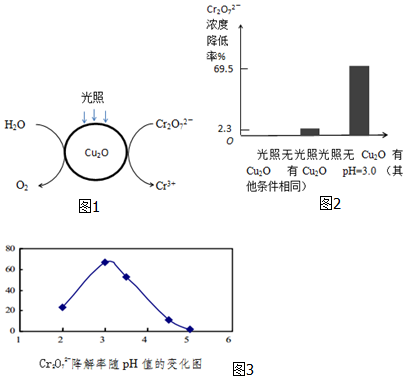
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时PbO2发生氧化反应 | |
| B. | 充电时电解质溶液的质量减少 | |
| C. | 放电时的负极反应式为Pb+SO42--2e-=PbSO4 | |
| D. | 充电时的阴极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中Ag和H2S均是还原剂,发生氧化反应 | |
| B. | 银针验毒时,空气中的氧气失去电子 | |
| C. | X的化学式为Ag2S,颜色为黑色,通过观察银针颜色变化来判断死者是否中毒 | |
| D. | 每生成1mo1X,反应转移4mo1 e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
| C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp>Ksp |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
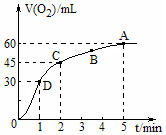 在50mL过氧化氢溶液中加入1g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )
在50mL过氧化氢溶液中加入1g MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示,下列说法不正确的是( )| A. | 标准状况下,实验放出一半气体所需的时间为1min | |
| B. | A、B、C、D各点反应速率中A点最慢,D点快 | |
| C. | 0~2min内产生O2的平均反应速率为22.5mL•min-1 | |
| D. | 本实验中影响反应速率的因素只有催化剂和H2O2的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com