
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:
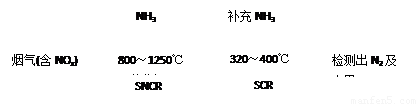
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ•mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ•mol-1;
6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ•mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ•mol-1;
6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ•mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ•mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH=
kJ•mol-1。
2NO(g)的ΔH=
kJ•mol-1。
(3)NO和NH3在Ag2O催化剂表面的反应活性随温度的变化曲线见图。
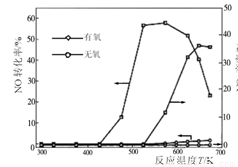
①由图可以看出,脱硝工艺流程应在 (填“有氧”或“无氧”)条件下进行。
②随着反应温度的进一步升高,在有氧的条件下NO的转化率明显下降的可能原因是 。
(4)NO2也可用尿素[CO(NH2)2]还原,写出尿素与NO2反应的化学方程式: 。
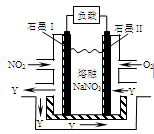
(5)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图11。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 。若生成1molY,则理论上需要消耗标准状况下氧气的体积为 L。
(1)<(2)179.8(3)①有氧②温度升高,发生了副反应:4NH3+7O2=4NO2+6H2O。(若答温度升高,NOx和NH3反应的化学平衡向逆反应方向移动也可。)(4)4CO(NH2)2+6NO2=7N2+4CO2+8H2O(5)NO2+NO3--e-=N2O5 11.2
【解析】
试题分析:(1)能自发进行的反应:ΔH-TΔS<0,该反应的ΔS<0,所以ΔH<0。(2)由盖斯定律得ΔH=(1807-1627.2)kJ•mol-1=+179.8 kJ•mol-1。(3)由图可知,无氧条件下NO转化率太低。温度升高,NO转化率下降,NO2产率增大,可能NH3与氧气生成了NO2。(4)尿素中C为+4价、N为-3价,尿素与NO2发生价态归中反应生成氮气,同时生成二氧化碳和水。(5)通二氧化氮的电极为负极、通氧气的电极为正极,石墨I电极上发生氧化反应,生成氧化物Y,考虑N最高价为+5价可知Y为N2O5,电极反应式为NO2+NO3--e-=N2O5。总反应为4NO2+O2=2N2O5,生成1molN2O5消耗氧气0.5mol。
考点: 化学反应进行的方向 盖斯定律 图像的分析 化学方程式的书写 电极反应式的书写 电化学计算


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
 (2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.c(N
| ||
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省长沙市高三第四次月考化学试卷(解析版) 题型:填空题
SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:
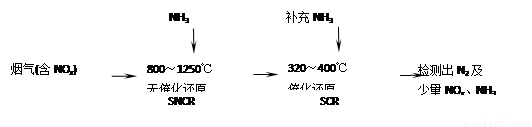
(1)反应2NO+2CO 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
(2)SNCR-SCR流程中发生的主要反应有:
①4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1627.2kJ•mol-1;
4N2(g)+6H2O(g) ΔH=-1627.2kJ•mol-1;
②6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1807.0 kJ•mol-1;
5N2(g)+6H2O(g) ΔH=-1807.0 kJ•mol-1;
③6NO2(g)+8NH3(g) 7N2(g)+12H2O(g) ΔH=-2659.9 kJ•mol-1;
7N2(g)+12H2O(g) ΔH=-2659.9 kJ•mol-1;
反应N2(g)+O2(g) 2NO(g)的ΔH=
kJ•mol-1。
2NO(g)的ΔH=
kJ•mol-1。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。
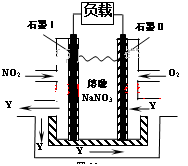
该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为:
(4)可利用该电池处理工业废水中含有的Cr2O72-,处理过程中用Fe作两极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀来除去Cr2O72-。
①写出电解过程中Cr2O72-被还原为Cr3+的离子方程式: 。
②该电池工作时每处理100L Cr2O72-浓度为0.002mol/L废水,消耗标准状况下氧气 L。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省日照市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有 。
(2) 可用尿素
可用尿素 还原(尿素中C元素的化合价为+4价),反应的方程式为:
还原(尿素中C元素的化合价为+4价),反应的方程式为: 。当消耗掉12g尿素时,转移电子的物质的量是
。
。当消耗掉12g尿素时,转移电子的物质的量是
。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的 ),改流程中发生的主要反应有:
),改流程中发生的主要反应有:

则反应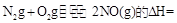 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反应方程式为 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
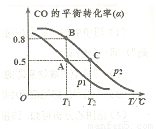
则该反应是 0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
(5)工业上用氨水将来 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为
;已知25℃时,0.05mol/L(NH4)2SO4溶液的
转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为
;已知25℃时,0.05mol/L(NH4)2SO4溶液的 ,则
,则 =
(用含a的代数式表示,已知
=
(用含a的代数式表示,已知 的电离常数
的电离常数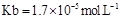 )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.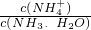 =______(用含a的代数式表示,已知NH3.H2O的电离常数Kb=1.7×10-5mol.L-1).
=______(用含a的代数式表示,已知NH3.H2O的电离常数Kb=1.7×10-5mol.L-1).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com