
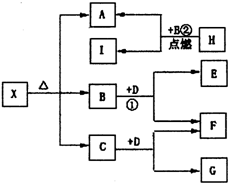
 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
| ||
| ||


科目:高中化学 来源: 题型:
| A、10g H2和10g O2 |
| B、7g N2和11g CO2 |
| C、9g H2O和0.5mol Br2 |
| D、224mL H2(标准状况)和0.1mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5 | B、4 | C、3 | D、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 经检验,“毒豆芽”中含有一种动物用药恩诺沙星,其分子结构如图所示,下列有关恩诺沙星的说法不正确的是( )
经检验,“毒豆芽”中含有一种动物用药恩诺沙星,其分子结构如图所示,下列有关恩诺沙星的说法不正确的是( )| A、难溶于水,可溶于烧碱和碳酸钠溶液 |
| B、分子式为C19H21FN3O3 |
| C、该物质能发生酯化、加成、氧化、硝化、水解反应 |
| D、该物质的一氯代物共有9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法, 的名称是2,3-二乙基丁烷 的名称是2,3-二乙基丁烷 |
B、某烃的衍生物A的分子式为C6H12O2,已知 ,又知D不与NaHCO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有4种 ,又知D不与NaHCO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有4种 |
| C、完全燃烧相同碳原子、且相同质量的烷烃、烯烃、炔烃,耗氧量最大的是烷烃 |
| D、已知烃A的分子式为C5Hm,烃B的最简式为C5Hn(m、n均为正整数),则烃A和烃B不可能互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液中,K+、Fe2+、SO42-、Br-可以大量共存 |
| B、溶液pH=1时,由水电离出的氢离子浓度为1×10-13 mol/L |
| C、1L 0.1mol/L该溶液和足量的Zn充分反应,生成1.12L H2 |
| D、稀溶液中通SO2反应的离子方程式为:2SO2+H2O+2NO3-=2SO42-+2NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液PH值变化曲线如图所示.下列说法不正确的是( )
向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液PH值变化曲线如图所示.下列说法不正确的是( )| A、HA是弱酸 |
| B、c点时,V=10.00ml |
| C、b点表示的溶液中:2c(Na+)=c(A-)+c(HA) |
| D、b、c、d点表示的溶液中c(Na+)+c(H+)=c(A-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S的酸性比H2SO4强 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制氢氧化铜悬浊液,水浴加热,未出现红色沉淀 | 蔗糖未水解 |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com