
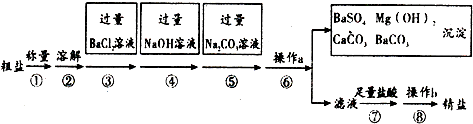
分析 (1)氯化钠溶液蒸发结晶获得氯化钠晶体的过程要用到玻璃棒,其作用为搅拌,使滤液受热均匀,防止液体飞溅;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是氯化钡剩余,则氯化钡会与硫酸钠反应出现白色沉淀;
(3)步骤⑤加入碳酸钠可以除去钙离子、钡离子,据此写出反应的化学方程式..
解答 解:实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,加入过量的氯化钡,可以将硫酸根离子除去,但是会引入钡离子杂质离子,加入过量氢氧化钠溶液的目的是除去氯化镁,加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠,
(1)操作b是对氯化钠溶液蒸发结晶获得氯化钠晶体的过程,此时玻璃棒的作用是:使滤液受热均匀,防止液体飞溅,
故答案为:蒸发结晶;搅拌防止液体溅出;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是氯化钡剩余,则氯化钡会与硫酸钠反应出现白色沉淀,所以判断BaCl2已过量的方法是:取少量样品于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则Bacl2过量,
故答案为:取少量样品于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则BaCl2过量;
(3)加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,发生的反应为:BaCl2+Na2CO3=BaCO3↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl,
故答案为:BaCl2+Na2CO3=BaCO3↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2NaCl.
点评 本题主要考查了粗盐的提纯,题目难度不大,除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③④⑦ | B. | 只有⑤⑥⑧⑨⑩ | C. | 只有①③⑤⑦⑨ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ②③④ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com