
| A��16��9 g����������BaO2����������������������ԼΪ0��2NA�� |
| B�����³�ѹ�£�28 g��ϩ�ͻ����飨C4H8���Ļ�������к��е�̼ԭ����Ϊ2NA |
| C����1 L 0��1 mol��L-1̼������Һ�У���������������0��1 NA |
| D��ij�ܱ�����ʢ��0��1molN2��0��3molH2����һ�������³�ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ0��6NA |
 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ZrO | B��Zr2O | C��Zr2O3 | D��ZrO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��lmolO2���еĵ�����Ϊ17NA |
| B����ⱥ��ʳ��ˮʱ������������22.4L����ʱת�Ƶĵ�����Ϊ2NA |
C�����³�ѹ�£�32g 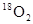 ��������������Ϊ20NA ��������������Ϊ20NA |
| D����ҵ��ͭ�ĵ�⾫��ʱ������ÿת��1mol����ʱ�������ܽ��ͭС��0.5 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��18g H2O�к���������Ϊ10NA |
| B�������£�23g NO2����NA����ԭ�� |
| C�����³�ѹ�£�22.4LCCl4���и�NA��CCl4���� |
| D��1L 0.1 mol��L��1 Na2SO4��Һ����0.2 NA��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��100mL0.1mol��L��1H2SO4��Һ | B��100mL0.1mol��L��1CH3COOH��Һ |
| C��50mL0.1mol��L��1MgCl2��Һ | D��100mLpH��1CH3COOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1 mol H2O��������18 g/mol |
| B��CH4��Ħ������Ϊ16g |
| C��3.01��1023��SO2���ӵ�������32 g |
| D����״���£�1 mol�κ����������Ϊ22.4 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 MnCl2+C12��+2H2O
MnCl2+C12��+2H2O�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com