


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省泰安市高三第二轮复习质量检测理综化学试卷(解析版) 题型:推断题
X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知:
①x元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且x原子半径小于Q的原子半径;
②Y元素是地壳中含量最多的元素;w元素的电负性略小于Y元素;在w原子的电子排布中,P轨道上只有1个未成对电子;
③Z元素的电离能数据见下表(kJ·mol-1)
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
(1)XY2分子空间构型为____________________________。QX的晶体结构与金刚石的相似,其中X原子的杂化方式为_______________,微粒间存在的作用力是____________。
(2)晶体ZW的熔点比晶体XW4明显高的原因是______________。
(3)氧化物MO的电子总数与QX的相等,则M为_____(填元素符号)。MO是优良的耐高温材料,其晶体结构与ZW晶体相似。MO的熔点比CaO的高,其原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三第三次诊断性测试化学试卷 题型:选择题
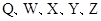 是原子序数依次增大的短周期元素,
是原子序数依次增大的短周期元素,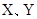 是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数W的2倍。工业上通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数W的2倍。工业上通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
A.原子半径:X>Y>Q>W
B.工业上一般通过电解饱和食盐水得到X的单质和氢气、氯气
C.W和Z组成的化合物可造成酸雨
D.Q、X和W三种元素形成化合物的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省吉安市高三第三次模拟考试(理综)化学部分 题型:填空题
X、Y、Z、Q、W为按原予序数由小到大排列的五种短周期元素。已知:①X与Q处于同一主族,其原子价电子排布式都为ns2np2,且X原子半径小于Q;②Y元素是地壳中含量最多的元素;W元素的电负性路小于Y元素,在W原子的价电子排布式中,p轨道上只有1个未成对电子;③Z元素的电离能数据见下表(kJ·mol-1)
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)XY2分子的空间构型为 。
(2)QX的晶体结构与金刚石的相似,微粒间存在的作用力是 。
(3)晶体ZW的熔点比晶体XW4明显高的原因是 。
(4)XY2在高温高压下所形成的晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)漏体,该晶体中X原子的杂化形式为___ 。

(5)氧化物MO的电子总数与QX的相等,则M为 。(填元素符号);MO是优良的耐高温材料,其晶体结构与ZW晶体结构相似,MO的熔点比CaO的高,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com