
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
| 实验目的 | 实验方案 | 所选玻璃仪器 |
A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
B | 证明HClO和CH3COOH的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol·L-1 NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
D | 配制1 L 1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4·5H2O溶解在975水中 | 烧杯、量筒、玻璃棒 |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源:2017届湖北省沙市高三上学期第三次考试化学试卷(解析版) 题型:选择题
下列关于含硫化合物的叙述不正确的是
A.SO2能与CaO反应,可用生石灰作工业废气的脱硫剂
B.SO2能使碘的淀粉溶液由蓝色变为无色,体现出漂白性
C.浓硫酸和Na2SO3反应制取SO2时,浓硫酸只表现酸性
D.医疗上曾用硫酸钡作X射线透视肠胃的内服药剂
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期开学考试化学试卷(解析版) 题型:填空题
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是内层电子数的3倍;E的+1价阳离子的核外有3层电子且各层均处于全满状态.
(1)E元素基态原子的核外电子排布式为 .
(2)B、C、D三种元素的第一电离能由小到大的顺序为 (填元素符号);
(3)B2A4是石油炼制的重要产物之一.B2A4分子中B原子轨道的杂化类型为 ;B2A4分子的空间构型是 ;1molB2A4分子中含σ键数目为 .
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期开学考试化学试卷(解析版) 题型:选择题
若15P原子的电子排布式写成1s22s22p63s23pX23PY1,它违背了( )
A. 能量守恒原理 B. 洪特规则
C. 能量最低原理 D. 泡利不相容原理
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上适应性考试(一)理综化学试卷(解析版) 题型:填空题
氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一。
(1)氨催化氧化法是工业制硝酸的主要方法。
已知:2NO(g)+3H2(g) 2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
2NH3(g)+O2(g) △H1=-272.9 kJ·mol-1, 2H2(g)+O2(g)═2H2O(g) △H2= -483.6kJ·mol-1,则4NH3(g)+5O2(g)=4NO(g)+ 6H2O(g)△H3= 。
(2)恒容密闭容器中进行合成氨反应N2(g) +3H2(g)  2NH3(g) △H4 = - 92. 4 kJ·mol-1,
2NH3(g) △H4 = - 92. 4 kJ·mol-1,
ΔS=-198.2J?mol-1?K-1。其化学平衡常数(K)与温度的关系如下表:
温度/K | 398 | 498 | … |
平衡常数(K) | K1 | K2 | … |
K1 K2(填“>”或“<”),请分析,298K时,合成氨反应能否自发进行 。
(3) 向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。下列说法正确的是 (填字母)。

A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为 。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为 。
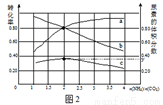
(5)氨碳比[n(NH3)/n(CO2)]对合成尿素的反应:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
CO(NH2)2(g)+H2O(g)有影响。T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和为3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数。[n(NH3)/n(CO2)] 时,尿素产量最大;该条件下反应的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省六安市高三上第一次月考化学试卷(解析版) 题型:实验题
锡及其化合物在生产、生活中有着重要的用途。已知: Sn2+易水解、易被氧化;SnCl4极易水解。请按要求回答下列相关问题:
(1)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤Ⅰ加入Sn粉的作用: __________________及调节溶液pH。
②步骤Ⅲ生成SnO的离子方程式:____________________________。
③步骤Ⅳ中检验SnO是否洗涤干净的操作是____________ ______,证明已洗净。
④步骤Ⅴ操作依次为____________、____________、过滤、洗涤、低温干燥。
(2)SnCl4蒸气遇氨气及水蒸气呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为:_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省六安市高三上第一次月考化学试卷(解析版) 题型:选择题
某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
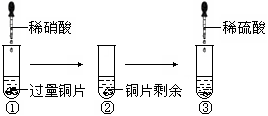
A.实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D.由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2017届安徽省淮北市濉溪县高三上学期9月月考化学试卷(解析版) 题型:填空题
铁是世界上用量最大的金属,铁及其化合物在生活、生产中有广泛应用。
请回答下列问题:
⑴ Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等。高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为 。34.8g Fe3O4与足量稀硝酸反应,被还原HNO3的物质的量为 mol。
⑵ FeCl3溶液是一种黄色透明液体,可用作止血剂,其原因是
;向煮沸的蒸馏水中加入几滴饱和FeCl3溶液,继续煮沸得到红褐色的Fe(OH)3胶体,鉴别FeCl3溶液与Fe(OH)3胶体的方法是 。
⑶ 高铁酸钠(Na2FeO4)是一种绿色水处理剂,具有杀菌消毒和聚沉水中杂质的作用,它的杀菌消毒原理是 。高铁电池是一种新型可充电电池,高铁电池的总反应为3Zn+2Na2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4NaOH。该电池充电时阳极的电极反应式为 。
3Zn(OH)2+2Fe(OH)3+4NaOH。该电池充电时阳极的电极反应式为 。
⑷ 铁红是一种重要的红色颜料,其主要成分是Fe2O3,将一定量的铁红溶于130mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L气体(标准状况),向反应后溶液中加入几滴KSCN溶液,溶液不变红色,则参加反应的铁粉质量为 。
查看答案和解析>>
科目:高中化学 来源:2017届河南省灵宝市高三上学期9月月考化学试卷(解析版) 题型:选择题
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是
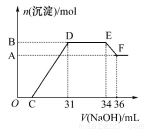
A.OC段离子反应方程式:H++OH-=H2O
B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
C.溶液中n(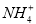 )=0.012 mol
)=0.012 mol
D.欲测定F点沉淀的质量,实验步骤是过滤、洗涤、干燥、称量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com