
| A. | O | B. | F | C. | S | D. | Cl |
科目:高中化学 来源: 题型:解答题

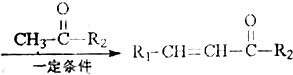 +H2O
+H2O ;反应②的反应类型取代反应.
;反应②的反应类型取代反应.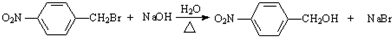 .
. .
.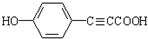 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
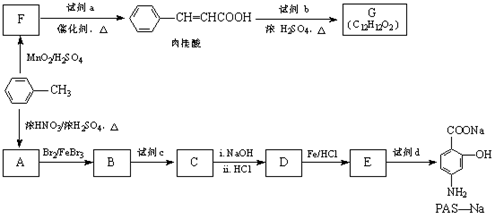
 (R-CH3或-H)
(R-CH3或-H) $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$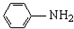
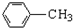 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$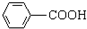
 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.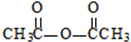 .
. .
.
 .(不用写条件)
.(不用写条件)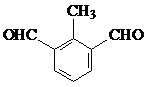 或
或  (任写一种即可).
(任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
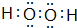 .
.查看答案和解析>>
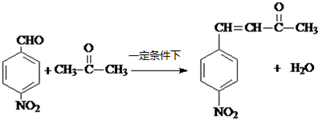
科目:高中化学 来源: 题型:推断题
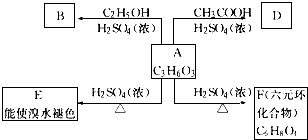
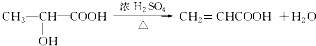 ;A→F
;A→F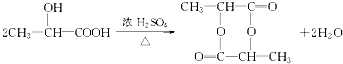
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| C. | 含4.8g碳元素的石墨晶体中的共价键数为1.2NA个 | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
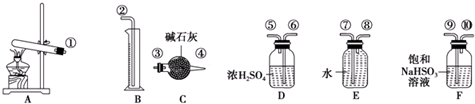
| 实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
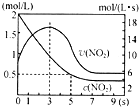 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: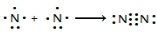 .
.| 化学键 | N-H | N-N | N═N | N≡N | O═O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6gCH4中含有的分子数 | |
| B. | 100 mL1mol/LH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下,22.4LCO气体中含有的分子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com