
下图是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是
甲 | 乙 | 丙 | 丁 | |
A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
B | Cu | CuO | CuSO4 | CuCl2 |
C | NO | HNO3 | NO2 | NH3 |
D | Si | Na2SiO3 | SiO2 | SiF4 |
科目:高中化学 来源:2015-2016学年安徽省高一上学期期中测试化学试卷(解析版) 题型:选择题
“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9 m,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料。如将“纳米材料”分散到蒸馏水中,所得混合物可能具有的性质是
A.有丁达尔效应
B.该分散系放置一段时间可能很快出现分层现象
C.不能透过滤纸
D.所得分散系一定是浊液
查看答案和解析>>
科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:选择题
临近元旦,某化学老师欲在元旦晚会上给同学们表演了一“繁星闪耀”的节目。具体的表演方法是在酒精与浓硫酸的混合物中加入一种固体物质,随着固体物质在溶液中缓缓下坠,溶液中便有似繁星闪耀的火光出现。老师加入的固体物质可能是
A.MgCl2 B.CH3COONa C.KMnO4 D.FeSO4
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:选择题
X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16。下列说法正确的是( )
A.Q与W能形成10电子, 不能形成14电子、18电子分子
B.Y的最高价氧化物对应水化物的化学式只能表示为H4YO4
C.Y、Z、Q分别与X化合,只能形成AB2型化合物
D.X、Z、W三种元素形成的两种钠盐溶液发生化学反应生成的气体可使品红溶液褪色
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第四次考试化学试卷(解析版) 题型:选择题
主族元素X在周期表中位于第二周期,其原子最外层电子数大于4,元素Y在周期表中位于第三周期,其原子最外层电子数小于4,有关其说法正确的是( )
A.X所形成的单质都是双原子分子
B.原子半径X>Y
C.X、Y能形成的阴、阳离子数之比为1:2离子化合物,其一定为碱性氧化物
D.由X、Y组成的某化合物与水反应能生成一种强碱和一种弱碱,其简单离子半径:X>Y
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中考试化学试卷(解析版) 题型:选择题
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
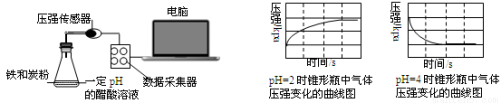
分析图像,以下结论正确的是( )
A.溶液pH ≤ 2时,生铁发生吸氧腐蚀
B.在酸性溶液中生铁只能发生析氢腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为Fe – 2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:填空题
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 ;
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 ;
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
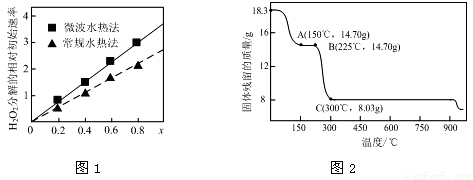
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
查看答案和解析>>
科目:高中化学 来源:2016届贵州遵义航天高中高三上学期第三次模拟理综化学试卷(解析版) 题型:实验题
某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42-)中提取铬。
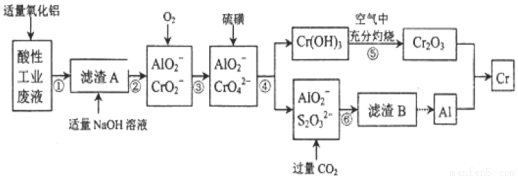
有关数据如下表:

回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4·7H2O,酸性工业废液中加入适量氧化铝的作用是 。
(2)若酸性废液中c(Mg2+)=0.lmol.L-l, 为达到步骤①的实验目的,则废液的pH应保持在 范围(保留小数点后l位)。
(3)步骤②中生成NaCrO2的离子方程式为 。
(4)步骤④中反应的离子方程式为 。
(5)步骤⑤在空气中充分灼烧的目的是 ,可选用的装置是 (填序号)。
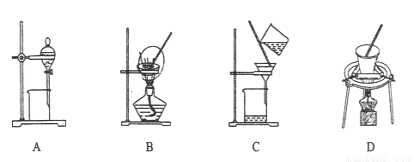
(6)用如图所示装置制取铬酸钠(Na2CrO4),回答相关问题。
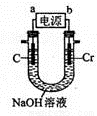
①a是电源的____极,阳极的电极反应式为________。
②若电解一段时间后阴极收集到标准状况下的气体3.36 L,则理论上可制得 g铬酸钠(忽略反应2CrO42-(aq) + 2H+(aq) Cr2O72-(aq)+ H2O(1)的影响)
Cr2O72-(aq)+ H2O(1)的影响)
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
下列除去杂质的方法正确的是
A.除去N2中的少量O2:通过灼热的CuO粉末
B.除去CO2中的少量HCl:通入Na2CO3溶液
C.除去KCl溶液中的少量K2CO3:加入适量的盐酸
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com