
【题目】标准状况下有:①6.72L CH4,②3.01×1023个HCl分子,③13.6g H2S,④0. 2molNH3。下列对这四种气体相关量的比较不正确的是
A. 体积:②>③>①>④ B. 密度:②>③>④>①
C. 质量:②>③>①>④ D. 氢原子数:①>④>③>②
【答案】D
【解析】试题分析:A.甲烷的体积是6.72L,3.01×1023个HCl分子的体积=![]() ×22.4mol/L=11.2L,13.6g H2S的体积=
×22.4mol/L=11.2L,13.6g H2S的体积=![]() ×22.4L/mol=8.96L,0.2mol NH3的体积=0.2mol×22.4L/mol=4.48L,所以气体体积大小顺序是②>③>①>④,故A正确;B.相同条件下,气体摩尔体积相同,根据ρ=M/Vm知,密度与其相对分子质量成正比,所以密度大小顺序是②>③>④>①,故B正确;C.甲烷的质量=
×22.4L/mol=8.96L,0.2mol NH3的体积=0.2mol×22.4L/mol=4.48L,所以气体体积大小顺序是②>③>①>④,故A正确;B.相同条件下,气体摩尔体积相同,根据ρ=M/Vm知,密度与其相对分子质量成正比,所以密度大小顺序是②>③>④>①,故B正确;C.甲烷的质量=![]() × 16 g/mol = 4.8g,氯化氢的质量=
× 16 g/mol = 4.8g,氯化氢的质量=![]() ×36.5g/mol=18.25g,硫化氢的质量是13.6g,氨气的质量=0.2mol×17g/mol=3.4g,所以质量大小顺序是②>③>①>④,故C正确;D.根据A知,这几种气体的物质的量分别是:甲烷的体积是6.72L其物质的量是0.3mol,氢原子的物质的量是1.2mol;3.01×1023个HCl分子的体积=11.2L,其物质的量是0.5mol,氢原子的物质的量是0.5mol;13.6g H2S的体积=8.96L,其物质的量是0.4mol,氢原子的物质的量是0.8mol;氨气的物质的量是0.2mol,氢原子的物质的量是0.6mol,氢原子个数大小顺序是①>③>④>②,故D错误。故选D。
×36.5g/mol=18.25g,硫化氢的质量是13.6g,氨气的质量=0.2mol×17g/mol=3.4g,所以质量大小顺序是②>③>①>④,故C正确;D.根据A知,这几种气体的物质的量分别是:甲烷的体积是6.72L其物质的量是0.3mol,氢原子的物质的量是1.2mol;3.01×1023个HCl分子的体积=11.2L,其物质的量是0.5mol,氢原子的物质的量是0.5mol;13.6g H2S的体积=8.96L,其物质的量是0.4mol,氢原子的物质的量是0.8mol;氨气的物质的量是0.2mol,氢原子的物质的量是0.6mol,氢原子个数大小顺序是①>③>④>②,故D错误。故选D。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s) ![]() C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=2 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为0.911g/cm3的氨水,溶液中溶质的质量分数为25%,该氨水用等体积的水稀释后,所得溶液质量分数为( )
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是 ( )
A. 越冬的植物体内自由水与结合水的比值下降,有利于抵抗不利的环境条件
B. 核酸是储存遗传信息、控制蛋白质合成的生物大分子
C. 淀粉、糖原、纤维素和核糖都是生物大分子
D. 多糖、蛋白质、核酸等是以碳链为骨架的生物大分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞中化合物或主要元素占细胞鲜重的含量,由多到少正确的排序是( )
A. 水、蛋白质、脂质、糖类 O、C、H、N
B. 水、蛋白质、糖类、脂质 C、O、H、N
C. 水、糖类、蛋白质、脂质 O、C、H、N
D. 水、脂质、蛋白质、糖类 O、N、C、H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用而产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____________(填“>”、“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2= 2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:

①上图(所有物质均为气态)能表示该反应过程中能量变化的是__________(填字母)。
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图所示,则CH4的转化率为 。
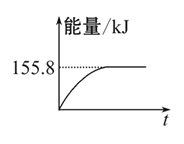
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH= 。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_____________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.将固态碳合成为C60,以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A. 活性炭有还原性,可用作制糖业脱色剂
B. 二氧化氯有强氧化性,可用于饮用水消毒
C. 氯化铁溶液呈酸性,可用于蚀刻铜电路板
D. 晶体硅的熔点高、硬度大,可用于制作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加人Na3P04,先生成___________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=____________mol/L。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
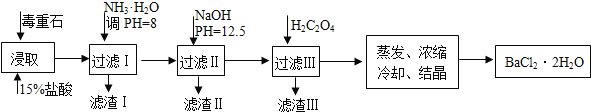
①毒重石用盐酸浸取前需充分研磨,目的是_____________________。
②加入NH3·H2O调节PH=8可除去_____________(填离子符号),滤渣II中含____________(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是

A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com