
| A. | 蛋白质、棉花、PVC、淀粉、涤纶都是由高分子组成的物质 | |
| B. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| C. | 雾霾天气的造成与PM2.5指数有着重要的关系,PM2.5是指大气中直径小于或等于2.5pm(皮米)的颗粒物 | |
| D. | 将废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 |
分析 A.蛋白质、棉花、PVC、淀粉、涤纶的相对分子质量均在10000以上;
B.乙醇和二甲醚分子式相同,结构不同,含H种类不同;
C.PM2.5是指大气中直径小于或等于2.5μm的细颗粒物;
D.油脂含C、H、O元素,可废物利用.
解答 解:A.蛋白质、棉花、PVC、淀粉、涤纶的相对分子质量均在10000以上,均为高分子,故A正确;
B.乙醇和二甲醚分子式相同,结构不同,含H种类不同,则二者互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者,故B正确;
C.PM2.5是指大气中直径小于或等于2.5μm的细颗粒物,雾霾天气的造成与PM2.5指数有着重要的关系,故C错误;
D.油脂含C、H、O元素,可废物利用,则废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念,故D正确;
故选C.
点评 本题考查三废处理及环境保护,为高频考点,把握物质的组成、结构、性质及化学与环境的关系为解答的关键,侧重分析与应用能力的考查,注意环境保护问题,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
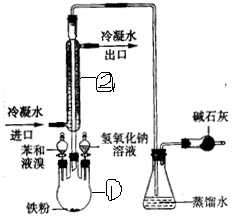
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
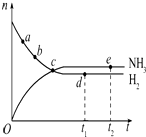 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a<b<2a | C. | 2a=b | D. | 2a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
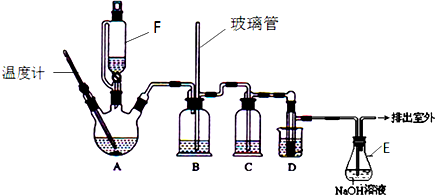
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)良好的生态环境可以提升生活质量.
(1)良好的生态环境可以提升生活质量.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
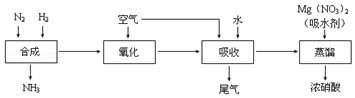
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com