
| A. | H2O2的电子式: | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 乙酸分子的球棍模型: | |
| D. | 离子结构示意图 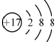 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
分析 A.双氧水为共价化合物,其分子中不存在阴阳离子;
B.二氧化硅晶体为原子晶体,不存在二氧化硅分子;
C. 为乙酸的比例模型,不是球棍模型;
为乙酸的比例模型,不是球棍模型;
D.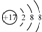 表示的是所有氯离子,与氯原子的中子数无关.
表示的是所有氯离子,与氯原子的中子数无关.
解答 解:A.双氧水属于共价化合物,电子式中不能表示出电荷,双氧水正确的电子式为: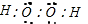 ,故A错误;
,故A错误;
B.SiO2为二氧化碳的化学式,二氧化硅晶体中不存在SiO2分子,故B错误;
C. 为比例模型,乙酸分子正确的球棍模型为:
为比例模型,乙酸分子正确的球棍模型为: ,故C错误;
,故C错误;
D.离子结构示意图 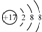 表示的是所有氯离子,可以表示35Cl-,也可以表示37Cl-,故D正确;
表示的是所有氯离子,可以表示35Cl-,也可以表示37Cl-,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,注意掌握球棍模型与比例模型、电子式、离子结构示意图、分子式与化学式的概念及区别,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
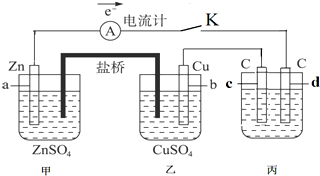
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用下图表示的一些物质或概念间的从属关系中不.正确的是( )
用下图表示的一些物质或概念间的从属关系中不.正确的是( )| X | Y | Z | |
| A | 强电解质 | 电解质 | 化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 置换反应 | 氧化还原反应 | 离子反应 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生吸氧或析氢腐蚀时,铁均作负极被氧化:Fe-3e-=Fe3+ | |
| B. | SO2气体通入Fe2(SO4)3溶液中:SO2+2H2O+2Fe3+=2Fe2++4H++SO42- | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$ 2Cu+O2↑+4H+ | |
| D. | 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-═BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com