
(12分)工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
① 4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
② 2Na2CrO4+H 2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
(1)工业上反应①需不断搅拌,其目的是 。
(2)下图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。
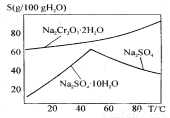
从Na2Cr2O7和 Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:
先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl进行复分解反应可制取K2Cr2O7,现用重铬酸钾测定铁矿石中铁的含量,测定原理为:Fe2++Cr2O72-+H+ Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)
实验步骤如下:
步骤1:将m g铁矿石加浓盐酸加热溶解 步骤2:加入SnCl2溶液将Fe3+还原
步骤3:将所得溶液冷却,加入HgCl2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15 mL硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用c mol·L-1重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液V mL
①如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
②步骤5使用的主要玻璃仪器有 。
③则测定铁矿石中铁的含量的计算式为 (用字母表示,不用化简)。
(1)使反应物接触更充分,加快反应速率(2分)
(2)除去析出Na2SO4的晶体,又能防止Na2Cr2O7·2H2O因冷却结晶析出而损失(2分)
冷却结晶(2分)
(3)①偏高(2分);②酸式滴定管 锥形瓶(2分);③56×6VC/1000m。
【解析】
试题分析:(1)工业上反应①需不断搅拌,其目的是使反应物接触更充分,加快反应速率;(2)根据图像可知红矾钠(Na2Cr2O7·2H2O)和的溶解度随温度的升高而增大,而Na2SO4的溶解度在温度是50℃下温度越高,溶解度越大;当温度超过50℃时,温度越高,溶解度反而越小。所以先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是除去析出Na2SO4的晶体,又能防止Na2Cr2O7·2H2O因冷却结晶析出而损失;然后将滤液冷却结晶,而析出红矾钠;(3)①如省去步骤③,则在反应过程中Sn2+氧化也需要消耗氧化剂重铬酸钾,因此会导致Fe的含量偏高;②步骤5是滴定操作,应该使用的仪器有盛装有强氧化性的物质重铬酸钾溶液的酸式滴定管,以及进行物质含量测定的反应容器锥形瓶;③6Fe2++Cr2O72-+14H+ == 6Fe3++ 2Cr3+ +7H2O 。n(重铬酸钾)= c mol/L×V mL×10-3L/ml=cv×10-3mol;由于在氧化还原反应中电子守恒,所以n(Fe2+)=6n(Cr2O72-)= 6cv×10-3mol.则测定铁矿石中铁的含量的计算式为[(6cv×10-3mol)×56g/mol]÷m g=56×6VC/1000m。
考点:考查影响化学反应速率的因素、混合物分离的方法、滴定方法在物质含量测定中的应用、误差分析的知识。


科目:高中化学 来源:2014-2015学年湖南省益阳市高二上学期期中化学(文)试卷(解析版) 题型:选择题
在2A+B  3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(B)=0.3 mol·L-1·s-1
B.v(A)=0.5 mol·L-1·s-1
C.v(C)=0.6 mol·L-1·s-1
D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是

A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
已知:Fe(s)+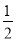 O2(g)===FeO(s) ΔH1=-272 kJ/mol
O2(g)===FeO(s) ΔH1=-272 kJ/mol
2Al(s)+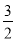 O2(g)===Al2O3(s) ΔH2=-1 675 kJ/mol
O2(g)===Al2O3(s) ΔH2=-1 675 kJ/mol
则2Al(s)+3FeO(s)===Al2O3(s)+3Fe(s)的ΔH是
A.859 kJ/mol B.-859 kJ/mol
C.-1403 kJ/mol D.-2491 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
现有等物质的量组成的Fe、Cu合金共0.1 mol,研成粉末后,全部投入稀硝酸中,微热使其充分反应,已知硝酸的还原产物只有NO。由于HNO3用量的不同,溶液中的金属离子和残留固体的成分会有多种情况。下列说法正确的是
A.根据溶液中的金属离子和残留固体的成分最多会有5种情况
B.若金属有剩余,在溶液中再滴入稀硫酸后,金属不会溶解
C.当合金刚好溶解时,在标准状况下产生2.24LNO
D.若合金全部溶解,在溶液中加入过量的氨水,(已知铜离子可转化为四氨合铜络离子溶于水)则经过滤、洗涤、干燥、充分灼烧、称量可得固体4g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。下列关于该反应的说法正确的是
A.CuSO4发生了氧化反应
B.氧化产物和还原产物的物质的量之比为5:6
C.白磷只作还原剂
D.该反应中被硫酸铜氧化的白磷有3mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:填空题
(14分)过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
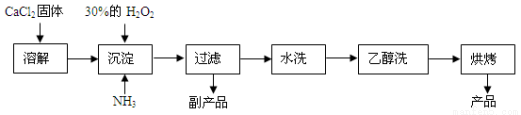
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①____________;②____________。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知: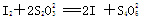 】
】
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列图示与对应的叙述不相符的是

A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com