

���� ��1���ٷ�Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ�
����֪��N2��g��+O2��g��=2NO��g����H1����
2CO��g��+O2��g��=2CO2��g����H2=-565KJ•mol-1����
���ݸ�˹���ɣ���-�ٿɵã�N2��g��+2NO=2CO2��g��+N2��g����
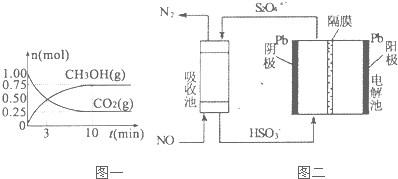
��2���������Ϊ2L���ܱ������У�����lmolCO2��3mol H2����ͼ��֪��10min����ƽ�⣬ƽ��ʱ����0.75 molCH3OH����
CO2��g��+3H2��g��=CH3OH��g��+H2O��g��
��ʼ��mol����1 3 0 0
ת����mol����0.75 2.25 0.75 0.75
ƽ�⣨mol����0.25 0.75 0.75 0.75
����v=$\frac{��c}{��t}$����v��H2O����
���ݱ���ʽK=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$����ƽ�ⳣ����
��A�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
B�������������Ũ�ȣ�ƽ��������Ӧ�����ƶ���
C��������Ӱ��ƽ���ƶ���
D��ֻ�����������Ũ�ȣ�ƽ��������Ӧ�����ƶ���
��3����ͼ��֪����������HSO3-��õ�������S2O42-�����������»�����ˮ�����ճ���S2O42-��NO��Ӧ����N2��HSO3-��
��4����HSO3-����õ�H+��SO32-����NH4+ˮ��ʹ��Һ������ǿ������HSO3-���룻
������SO2��ļ�����Һ��������C12��������C12�����Һ�Գ�ǿ���ԣ�˵��NaOH��ʣ�࣬ͨ������һ��������Ӧ��SO32-+C12+2OH-=SO42-+2Cl-+H2O��
��Һ���������������嵥�ʷ�Ӧ��ʹ��ˮ��ɫ��ȥ������֤����Һ�к���SO32-��
��� �⣺��1���ٷ�Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ����H1=945kJ/mol+498kJ/mol-2��630kJ/mol=+183kJ/mol���ʴ�Ϊ��+183kJ/mol��
����֪��N2��g��+O2��g��=2NO��g����H1=+183kJ/mol ��
2CO��g��+O2��g��=2CO2��g����H2=-565KJ•mol-1 ��
���ݸ�˹���ɣ���-�ٿɵã�N2��g��+2NO=2CO2��g��+N2��g����H=-748kJ/mol��
�ʴ�Ϊ��N2��g��+2NO=2CO2��g��+N2��g����H=-748kJ/mol��
��2���������Ϊ2L���ܱ������У�����lmolCO2��3mol H2����ͼ��֪��10min����ƽ�⣬ƽ��ʱ����0.75 molCH3OH����
CO2��g��+3H2��g��=CH3OH��g��+H2O��g��
��ʼ��mol����1 3 0 0
ת����mol����0.75 2.25 0.75 0.75
ƽ�⣨mol����0.25 0.75 0.75 0.75
��v��H2O��=$\frac{\frac{0.75mol}{2L}}{10min}$=0.0375mol/��L��min����
ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH����c��{H}_{2}O��}{c��C{O}_{2}����{c}^{3}��{H}_{2}��}$=$\frac{\frac{0.75}{2}��\frac{0.75}{2}}{\frac{0.25}{2}����\frac{0.75}{2}��^{3}}$=$\frac{64}{3}$��
�ʴ�Ϊ��0.0375mol/��L��min����$\frac{64}{3}$��
��A������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�ƶ�����A����
B�������������Ũ�ȣ�ƽ��������Ӧ�����ƶ�����B��ȷ��
C��ʹ�ø�Ч�������̵���ƽ���ʱ�䣬����Ӱ��ƽ���ƶ�����C����
D�������������Ũ�ȣ�ƽ��������Ӧ�����ƶ�����D��ȷ��
��ѡ��BD��
��3����ͼ��֪����������HSO3-��õ�������S2O42-�����������»�����ˮ���缫��ӦʽΪ��2HSO3-+2H++2e-=S2O42-+2H2O�����ճ���S2O42-��NO��Ӧ����N2��HSO3-����Ӧ���ӷ���ʽΪ��2S2O42-+2NO+2H2O=N2+4HSO3-��
�ʴ�Ϊ��2HSO3-+2H++2e-=S2O42-+2H2O��2S2O42-+2NO+2H2O=N2+4HSO3-��
��4����HSO3-?H++SO32-����NH4+ˮ�⣺NH4++H2O?NH3��H2O+H+��ʹ��Һ��c��H+����������HSO3-���룬��NH4HSO3��Һ��SO32-Ũ�Ƚ�С��
�ʴ�Ϊ��NH4HSO3��HSO3-?H++SO32-����NH4+ˮ�⣺NH4++H2O?NH3��H2O+H+��ʹ��Һ��c��H+����������HSO3-���룬��Һ��SO32-Ũ�ȼ�С��
������SO2��ļ�����Һ��������C12��������C12�����Һ�Գ�ǿ���ԣ�˵��NaOH��ʣ�࣬ͨ������һ��������Ӧ��SO32-+C12+2OH-=SO42-+2Cl-+H2O��������C12�����Һ�г�OH-�⣬һ��������SO42-��Cl-��������Һ���������������嵥�ʷ�Ӧ��ʹ��ˮ��ɫ��ȥ������֤����Һ�к���SO32-����Ӧ���ӷ���ʽΪ��Br2+2OH-=BrO-+Cl-+H2O��
�ʴ�Ϊ��SO42-��Cl-��Br2+2OH-=BrO-+Cl-+H2O��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���Ӧ�ȼ��㡢�Ȼ�ѧ����ʽ��д������ˮ�⡢���ԭ���ȣ���ʵ��ѧ���ۺ������Ŀ��飬�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȼ�� | B�� | ���ȶ��� | C�� | �ӷ��� | D�� | ��ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ������ | Fe��OH��2 | Fe��OH��3 | Al ��OH��3 |
| ��ʼ����ʱ��pH | 7.0 | 1.9 | 3.4 |
| ��ȫ����ʱ��pH | 9.0 | 3.2 | 4.7 |
| ʵ����� | ���� | ���� |
| ȡ������Ʒ�ڽྻ�ձ��У�������������ˮ����ֽ��裬���ã���ȥ������ | �û���ɫ��Һ | |
| ȡ������Һ���Թ��У��μ���Һ ��0.05mol/L���Ը�����أ� | ����Һ����ɫ�� | ��Һ�в���Fe2+ |
| ȡ������Һ���Թ��У��μ�0.1 mol/L BaCl2��Һ���ٵμ�20% HNO3��Һ | �۲�����ɫ������ | ��Һ�к���SO${\;}_{4}^{2-}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϡ��ˮ�еμ�ϡ������ǡ���кͣ�[NH4+]�T[Cl-] | |
| B�� | ��������Һ�У�[Na+]+[H+]�T[OH-]+2[SO42-] | |
| C�� | 0.1mol?L-1Na2S��Һ�У�[S2-]+[HS-]+[H2S]�T[Na+] | |
| D�� | ��CH3COONa��Һ�м���������ˮ��[CH3COO-]��[OH-]����С��[OH-]/[CH3COO-]Ҳ��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
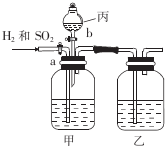 Ϊ�˷���H2��SO2�����ֱ�õ���������壬ijѧ�������һ��ʵ��װ�ã���a��bΪ��������ÿ��װ���е���Һ��������
Ϊ�˷���H2��SO2�����ֱ�õ���������壬ijѧ�������һ��ʵ��װ�ã���a��bΪ��������ÿ��װ���е���Һ���������鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com