
 ,有关该化合物的下列说法错误的是( )
,有关该化合物的下列说法错误的是( )| A. | 分子式为C12H18O2 | |
| B. | 分子中至少有6个碳原子共平面 | |
| C. | 该化合物能使酸性高锰酸钾褪色 | |
| D. | 一定条件下,1mol该化合物最多可与3mol H2加成 |
分析 有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代反应,含有羰基,可发生加成反应,以此解答该题.
解答 解:A.由结构简式可知有机物分子式为C12H18O2,故A正确;
B.碳碳双键具有平面型结构,与碳碳双键直接相连的原子可能在同一个平面上,则分子中至少有4个碳原子共平面,故B错误;
C.含有碳碳双键,可被酸性高锰酸钾氧化,则可使酸性高锰酸钾褪色,故C正确;
D.能与氢气发生加成反应的为碳碳双键和羰基,则1mol该化合物最多可与3mol H2加成,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,为解答该类题目的关键,难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
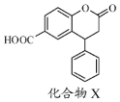
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 1 mol化合物X最多能与2 molNaOH反应 | |
| D. | 在酸性条件下水解,水解产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+Ba2+→BaCO3↓ | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-=H2O+BaCO3↓ | |
| D. | 2HCO3-+Ba2++2OH-→BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4+NaOH=Na2SO4+H2O | B. | CH3COOH+NaOH→CH3COONa+H2O | ||
| C. | H2SO4+Ba(OH)2→BaSO4↓+2H2O | D. | NH3•H2O+HCl→NH4Cl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
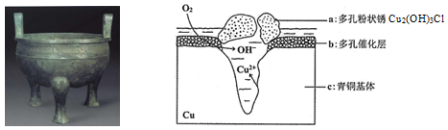
| A. | 青铜器发生电化学腐蚀,图中c作负极,被氧化 | |
| B. | 正极发生的电极反应为O2+4e-+2H2O=4OH- | |
| C. | 环境中的Cl-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| D. | 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
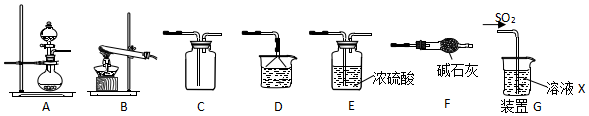
| 实验 | 操作 | 现象 | 结论和解释 |
| 2 | 将SO2通入0.1mol/LFeCl3和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
| 3 | 将SO2通入0.01mol/LHNO3 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II | 判断 |
| A | 氢氧化铝可用于治疗胃酸过多 | Al(OH)3可与盐酸反应 | I对,II对,有 |
| B | SiO2可用作光导纤维 | SO2是良好的半导体 | I对,II对,有 |
| C | Al2O3作耐火材料 | Al2O3具有高熔点 | I对,II错,无 |
| D | HF可用来蚀刻玻璃 | HF是强酸 | I对,II对,无 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
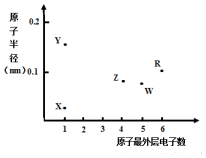 X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )
X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Y<W | |
| B. | 最高价氧化物对应水化物的酸性:Z<W | |
| C. | R为氧元素 | |
| D. | X与Z可以形成正四面体结构的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L HCl溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L CaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com