
下列关于有机物的描述中正确的是( )
A 葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体
B 利用蛋白质的颜色反应可以鉴别所有的蛋白质
C 多糖、蛋白质、脂肪和聚丙烯等都属于高分子化合物
D 食醋中的主要成分为乙酸,普通食醋中含有3%- 5%的乙酸
科目:高中化学 来源: 题型:
下列方程式书写正确的是
A.HCO3-的电离方程式:HCO3-+ H2O  H2CO3 + OH-
H2CO3 + OH-
B.NH3·H2O的电离方程式:NH3·H2O NH4+ + OH-
NH4+ + OH-
C.CO32-的水解方程式: CO32- + 2H2O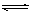 H2CO3 + 2OH-
H2CO3 + 2OH-
D.NH4Cl的水解方程式:NH4+ + H2O===NH3·H2O + H+
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色。这三种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)X与Y在溶液中反应的离子方程式为______________________________。
(2)利用如图装置(夹持固定装置已略去)进行实验,在装置Ⅰ中加入X,装置Ⅱ中加入一种淡黄色固体物质进行反应,装置Ⅲ中生成白色沉淀,装置Ⅴ中可收集到一种无色气体。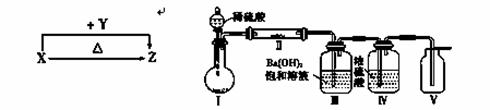
①装置Ⅱ中反应的化学方程式为_____________________。Ⅲ的作用是 。
检验装置Ⅴ中物质的方法是____________________________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的Ⅴ中的气体,所需仪器装置是________(从上图选择必要装置,填写编号)。
反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有3个电子。
(1)C原子的基态电子排布式为__________;若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式分类,A与C形成的最简单化合物中的共价键属于__________键。
(2)当n=2时,元素A在周期表中的位置是__________,B与C形成的化合物的VSEPR模型名称为__________形。
(3)当n=3时,B与C形成的晶体类型是__________,此时A、B、C、D四种元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,甲、乙、丙、丁四种气态烃的分子中所含电子数分别为10、14、16、18,下列关于这四种气态烃的推断正确的是( )
A. 四种气态烃中至少有两种互为同分异构体
B. 可以用酸性高锰酸钾溶液鉴别甲和丁
C. 丙分子中所有原子均在同一平面上
D. 乙和丁属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2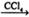 CH3CHBrCH2Br ②CH3CH2OH
CH3CHBrCH2Br ②CH3CH2OH 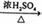 CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH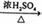 CH3COOCH2CH3+H2O ④2CH3CH2OH
CH3COOCH2CH3+H2O ④2CH3CH2OH 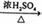 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
A. ①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是 ( )
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
A.①③ B.②④ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G七种位于周期表前四周期元素,其原子序数依次增大,相关信息如下表所示:
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
根据以上信息,回答下列问题:
⑴ 画出元素C的基态原子核外电子排布图: ;G元素位于周期表的 区;
B、C、D三种元素的第一电离能由大到小顺序为: (用元素符号表示)。
⑵ 化合物BA2D2蒸气293 K时,理论测算密度为2.0g·L-1,实际密度为2.5 g·L-1的原因是 。
⑶ FD2中F原子的杂化类型为 ;分子空间构型为 ;FD2易溶于水的原因可能是: (填入序号)。
①FD2与水极性相同 ②FD2可以与水反应
⑷ 有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com