
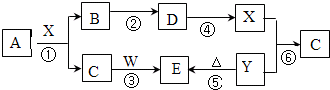
| ||
| △ |
| ||
| △ |
| ||
| ||
| ||
| △ |
| ||
| △ |
| ||
| 22.4L |
| 22.4L/mol |
| ||


科目:高中化学 来源: 题型:阅读理解
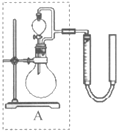 (2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
| ||
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
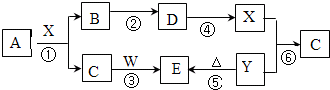
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
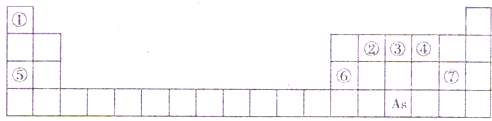
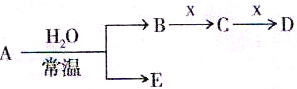
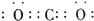
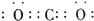
查看答案和解析>>
科目:高中化学 来源: 题型:
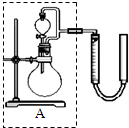 过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
| ||
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com