
分析 (1)常温下Kw=10-14;溶液的酸碱性,就分析氢离子和氢氧要根离子浓度的相对大小,常温下比较PH的大小;根据c(H+)=10-pH计算;
(2)氯化铁为强酸弱碱盐,水解呈酸性,配制溶液时应防止水解生成沉淀而使溶液变浑浊.
解答 解:(1)常温下Kw=c(H+)×c(OH-)=10-14,当溶液中氢离子的浓度大于氢氧根离子的浓度溶液呈酸性,常温下PH小于7,故答案为:10-14;>;<;
(2)氯化铁为强酸弱碱盐,水解呈酸性,水解离子方程式为Fe3++3H2O≒Fe(OH)3+3H+,配制溶液时应防止水解生成沉淀而使溶液变浑浊,则应加入盐酸,
故答案为:Fe3++3H2O≒Fe(OH)3+3H+;抑制氯化铁的水解.
点评 本题考查了溶液pH的计算、盐类水解的应用等知识点,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,明确pH的计算方法、弱酸溶液中氢离子浓度与溶液pH的关系是解本题关键,难度不大.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
 ;
;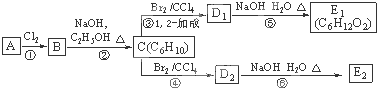
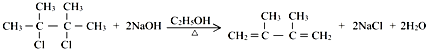 ;
; +Br2→
+Br2→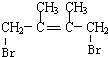 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
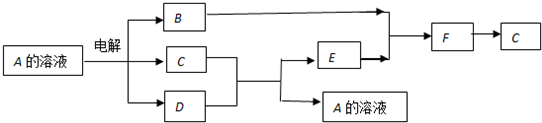
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
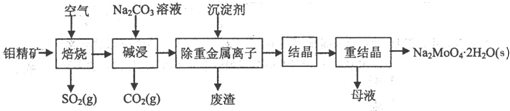

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
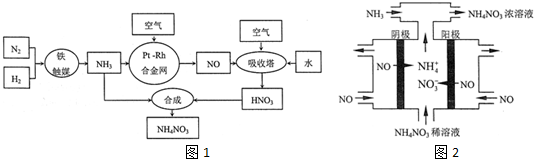
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com