
| A. | pH=2的溶液 | B. | c(H+)=1×10-7mol/L的溶液 | ||
| C. | c(OH-)=1×10-5mol/L的溶液 | D. | pH=9的溶液 |
分析 溶液酸碱性的实质是如果溶液中氢离子的浓度大于氢氧根离子的浓度,那么显酸性,相反则显碱性,相等时呈中性,水的离子积常数KW=c(H+)•c(OH?),
常温下,KW=1×10-14,c(H+)=c(OH-)=1×10-7mol/L,溶液呈中性,PH=7;
酸性水溶液,c(H+)>c(OH?),pH<7,pH值越小,表示酸性越强;
碱性水溶液,c(H+)<c(OH?),pH>7,pH值越大,表示碱性越强.
解答 解:常温下,KW=1×10-14,c(H+)=c(OH-)=1×10-7mol/L,溶液呈中性,PH=7;
酸性水溶液,c(H+)>c(OH?),pH<7,pH值越小,表示酸性越强;
碱性水溶液,c(H+)<c(OH?),pH>7,pH值越大,表示碱性越强;
A.pH=2<7,溶液呈酸性,故A正确;
B.c(H+)=1×10-7mol/L,溶液呈中性,故B错误;
C.c(OH-)=1×10-5mol/L,c(H+)=1×10-9mol/L,c(H+)<c(OH?),溶液呈碱性,故C错误;
D.pH=9>7,溶液呈碱性,故D错误;
故选:A.
点评 本题考查溶液酸碱性判断,为高频考点,根据溶液中c(H+)、c(OH-)相对大小判断溶液酸碱性,常温下PH值也能判断溶液的酸碱性,题目比较简单.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 约-40℃ | B. | 低于-162℃ | C. | 低于-89℃ | D. | 高于36℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
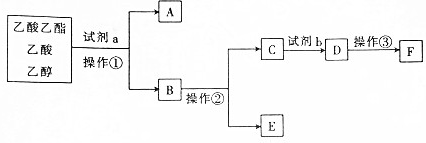
| A. | 操作②是蒸馏 | |
| B. | 试剂a可能是饱和碳酸钠溶液 | |
| C. | 试剂b比同浓度的D溶液酸性强 | |
| D. | A与E在浓硫酸加热的条件下可生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
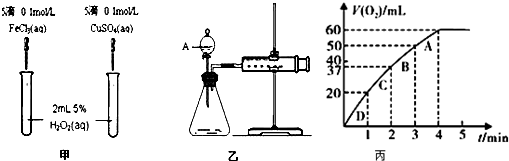
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
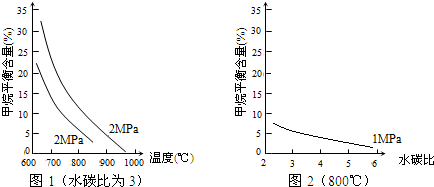
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
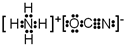 或
或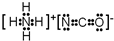 .
.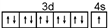 .A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.
.A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.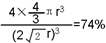 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com