


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
| 盐 | 熔点/℃ | 熔化吸热/ kJ·mol-1 | 参考价格/元·千克-1 |
| CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4·12H2O | 36.1 | 100.1 | 1 600~2 000 |
| Na2S2O3·5H2O | 48.5 | 49.7 | 1 400~1 800 |

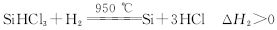 关于上述条件下两个反应的叙述中不正确的是______________。
关于上述条件下两个反应的叙述中不正确的是______________。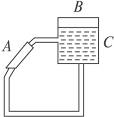
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(石墨) C(金刚石) ΔH=+19 kJ·mol-1可知,金刚石比石墨稳定 C(金刚石) ΔH=+19 kJ·mol-1可知,金刚石比石墨稳定 |
C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:H2(g)+ (g)====H2O(l) ΔH=+285.8 kJ·mol-1 (g)====H2O(l) ΔH=+285.8 kJ·mol-1 |
| D.在稀溶液中:H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1,若将0.5 mol浓硫酸溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水在高温加热后变成水蒸气 |
| B.生石灰变熟石灰 |
| C.石墨转变为金刚石 |
| D.钠投入水中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
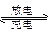 Zn(OH)2+2Ag____________________________________________。
Zn(OH)2+2Ag____________________________________________。 4CO2+2H2O__________________________________________________。
4CO2+2H2O__________________________________________________。 C6H12O6+6O2______________________________________________。
C6H12O6+6O2______________________________________________。 CaO+CO2↑______________________________________________________。
CaO+CO2↑______________________________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
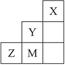
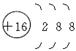
| A.Y、Z可形成ZY6分子 | B.X晶体属于原子晶体 |
| C.原子半径:Z>M>Y | D.Z2-离子的结构示意图可表示为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
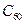 形成的球碳盐
形成的球碳盐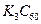 。实验测知该物质属于离子晶体,具有良好的超导性。下列关于
。实验测知该物质属于离子晶体,具有良好的超导性。下列关于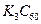 的组成和结构的分析中,正确的是( )
的组成和结构的分析中,正确的是( )A.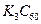 中既有离子键,又有非极性键 中既有离子键,又有非极性键 |
B.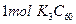 中含有的离子数目为 中含有的离子数目为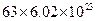 |
| C.该晶体能导电,但在熔融状态下不能导电 |
D.该物质的化学式可写为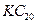 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com