
标准状况下,将a L H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b mol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO3-,且三者物质的量之比为8∶1∶1,则原混合气体中H2的物质的量为
A.a/2 mol B.a/22.4b mol
C.a/22.4-0.5bmol D.b/2mol
科目:高中化学 来源:2016届山东省高三上10月阶段质检化学试卷(解析版) 题型:选择题
微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,
电极反应式为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,
总反应式为:Ag2O+Zn===ZnO+2Ag 根据上述反应式,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH增大
B.在使用过程中,电子由Ag2O经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn极发生还原反应,Ag2O极发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期10月调考理综化学试卷(解析版) 题型:选择题
为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W0 g样品进行实验,下列实验方法所对应的实验方案和测量数据最合理(除W0外)的是
实验方法 | 实验方案 | 测量数据 | |
A. | 滴定法 | 将样品配成100 mL溶液,取10 mL,加入甲基橙,用 标准盐酸滴定 | 消耗盐酸的体积 |
B. | 量气法 | 将样品与盐酸反应,生成的气体全部被碱石灰吸收 | 碱石灰增重 |
C. | 重量法 | 样品放入烧瓶中,置于天平上,加入足量盐酸 | 减轻的质量 |
D. | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
查看答案和解析>>
科目:高中化学 来源:2016届福建省莆田市高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是

选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝色 | Cl2具有氧化性 |
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期第二次检测化学试卷(解析版) 题型:选择题
科技工作者研究出以NH3 为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900 ℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
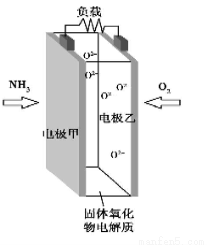
A.电极甲为电池正极
B.电池总反应为4NH3+5O2 =4NO+6H2O
C.电池正极反应式为O2+2H2O+4e-=4OH-
D.图示中的O2-由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学高一上10月阶段测化学试卷(解析版) 题型:填空题
(10分)
(1)配制100mL 1mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4 (密度为1.84 g·mL-1,质量分数为98%)的体积为_________________mL。
(2)等温等压下,等体积的CO2和O3所含分子个数比为 ,原子个数比为 ,密度比为 。
(3)有12.4g Na2R含Na+ 为0.4mol,则Na2R的摩尔质量为 ,R的相对原子质量为 。
(4)在标准状况下1.7g氨气所占的体积为 L,它与同条件下 mol H2S含有相同的氢原子数。
(5)100mL 0.5mol/L的(NH4)2SO4溶液中含有NH4+___________________mol,这些NH4+中所含有的电子数为___________________。
查看答案和解析>>
科目:高中化学 来源:2016届上海市高三上学期摸底测试化学试卷(解析版) 题型:填空题
填空题(共9分)下表中列出了五种短周期元素A、B、C、D、E的信息,请推断后作答:
元素 | 有关信息 |
A | 元素主要化合价为-2,原子半径为0.074nm |
B | 所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
C | 原子半径为0.102nm,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
D | 最高价氧化物对应水化物,能按1:1电离出电子数相等(10个电子)的阴阳离子 |
E | 原子半径为0.075nm,最高价氧化物对应水化物与其氢化物组成一种盐X |
1.写出A、E两种元素符号 、 。
2.画出B原子的核外电子排布式: ;写出D元素最高价氧化物对应水化物的电子式: 。
29.盐X水溶液显 (选填“酸”、“碱”或“中”)性,用离子方程式解释其原因: 。
30.D2CA3的溶液与B的单质能发生氧化还原反应,其反应的离子方程式为 。
31.已知E元素的某种氢化物Y与A2的摩尔质量相同,Y在常温下为液态,Y的化学式为 ,Y所含的化学键为 。
(a)极性键 (b)非极性键 (c)离子键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第二次月考化学试卷(解析版) 题型:计算题
取一定量Na2CO3和Na2SO4的混合物溶液分成两等份,一份与过量盐酸反应,生成2.016 L CO2(标准状况下),另一份加入足量的Ba(OH)2溶液,得到沉淀的质量为20.06 g。试计算原混合物中Na2CO3和Na2SO4的物质的量分别为多少?(写计算过程)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
中和滴定是一种操作简单、准确度高的定量分析方法。实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4——紫红色
B.利用“Ag++SCN-===AgSCN↓”原理,可用标准KSCN溶液测定AgNO3溶液浓度:Fe(SCN)3——红色
C.利用“2Fe3++2I-===I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量:淀粉——蓝色
D.利用OH-+H+===H2O来测量某盐酸的浓度时:酚酞——浅红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com