
| A. | H2O | B. | 液NH3 | C. | 液态HF | D. | 纯H2SO4 |
分析 醋酸电离出醋酸根离子和氢离子,电离方程式为CH3COOH?CH3COO-+H+,根据影响电离平衡的因素判断.
解答 解:A.加水稀释促进醋酸的电离,CH3COOH?CH3COO-+H+,向正方向移动,但是移动程度较小;
B.加液NH3,NH3会与H+反应,CH3COOH?CH3COO-+H+,向正方向移动,移动程度比A大;
C.加液态HF,HF电离的H+,会抑制CH3COOH的电离,电离平衡向左移动;
D.加纯H2SO4,H2SO4电离的H+,会抑制CH3COOH的电离,电离平衡向左移动;
所以电离程度最大的是B.
故选B.
点评 本题考查了弱电解质的电离,明确电离平衡的影响因素、弱电解质电离程度与溶液浓度的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1molFeSO4•7H2O的质量为278g/mol | |
| B. | FeSO4•7H2O的摩尔质量为278g | |
| C. | 配制100mL 0.1mol/L FeSO4溶液需要FeSO4•7H2O 2.78g | |
| D. | 配制100mL 0.1mol/L FeSO4溶液需要FeSO4•7H2O 1.52g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
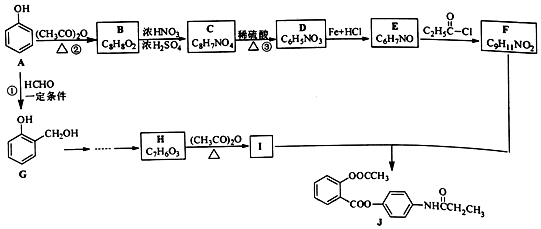
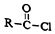 +R′-NH2→
+R′-NH2→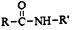 +HCl
+HCl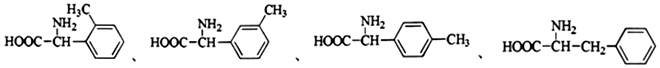 .
.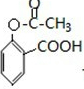 ;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;
;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;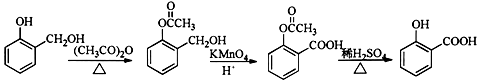 .
.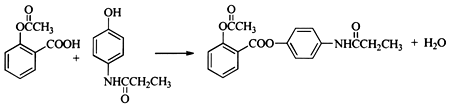 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
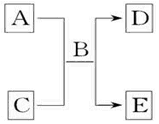 A、B、C、D和E均为中学化学常见的纯净物,其中B为自然界中含量最多的液体,它们之间有如图反应关系:
A、B、C、D和E均为中学化学常见的纯净物,其中B为自然界中含量最多的液体,它们之间有如图反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 一定条件下,铁粉可与水蒸气反应生成四氧化三铁和氢气 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 纯铁的硬度和熔点均低于铁合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 8:1 | C. | 1:1 | D. | 800:108 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com