
(9分)下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
| ① | | | | | | | | | |||||||||
| | | | ④ | ⑤ | ⑥ | | | ||||||||||
| ② | | | ③ | | | | ⑦ | | |||||||||
| | | | | | | | Fe | | | | | | | | | | |
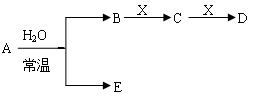
(9分)(1) 3NO2 +H2O=2HNO3 + NO ①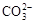 +H2O
+H2O 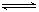
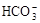 +OH-
+OH-
② Fe + 4H+ +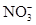 =Fe3+ + NO↑+2H2O (2)Na 、Na2O2或NaH;(3分)
=Fe3+ + NO↑+2H2O (2)Na 、Na2O2或NaH;(3分)
(除注明外每空2分)
解析试题分析:(1)若E为氧化物,则常温下能和水反应生成氧化物的物质只有NO2,所以A是NO2,E是NO,B是硝酸,反应的化学方程式是3NO2 +H2O=2HNO3 + NO。根据转化可知,当X是碱性盐溶液,C分子中有22个电子,则C是CO2,所以X是碳酸盐,则D是碳酸氢盐,所以反应的方程式是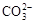 +H2O
+H2O 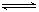
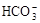 +OH-;当X为金属单质时,X一定是变价的金属,所以X是铁,则C是硝酸铁,D是硝酸亚铁。反应的离子方程式是Fe + 4H+ +
+OH-;当X为金属单质时,X一定是变价的金属,所以X是铁,则C是硝酸铁,D是硝酸亚铁。反应的离子方程式是Fe + 4H+ +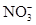 =Fe3+ + NO↑+2H2O。
=Fe3+ + NO↑+2H2O。
(2)(2)若E为单质气体,D为白色沉淀,所以符合条件的应该是钠或过氧化钠或NaH。此时E是氧气,B是氢氧化钠X是氯化铝,C是偏氯酸钠,D是氢氧化铝。
考点:考查根据框图进行的有关判断
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。


科目:高中化学 来源: 题型:
(12分
下图是元素周期表的一部分:
⑴表中区域名称s、p……等确定的依据是_______________________________________。
⑵已知A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A的核外电子排布式为______________,B在元素周期表中的位置是___________。
⑶上表中元素x的一种氢化物的晶体结构如图所示,写出该化合物在氯气中燃烧的化学方程式 。
除x外,第四周期中最外层只有一个电子的还有 (填元素名称)。
⑷表中短周期非金属元素之间可以形成形形色色的有机物,如邻羟基苯甲醛()和对羟基苯甲醛(
),前者沸点低于后者,理由是
_____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)下图是元素周期表中的一部分。
在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。
请回答:
(1)硅的相对原子质量为 ;原子序数为8的元素位于元素周期表的第 周期,元素符号为 ,它属于 (填“金属”或“非金属”)元素。
(2)原子半径:钠 镁(填“>”或“=”或“<”,下同),原子得电子能力:硫 氯。
查看答案和解析>>
科目:高中化学 来源:2014届辽宁瓦房店高级中学高二上学期期中考试化学试卷(解析版) 题型:填空题
(9分)下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
|
① |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
④ |
⑤ |
⑥ |
|
|
||||||||||
|
② |
|
|
③ |
|
|
|
⑦ |
|
|||||||||
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
|
|
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
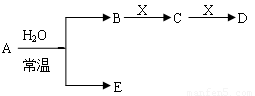
(1)若E为氧化物,则A与水反应的化学方程式为 ,①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是
查看答案和解析>>
科目:高中化学 来源:2012届江苏省淮安五校高二上学期期末考试化学试卷 题型:填空题
(12分)下图是元素周期表中的一部分。
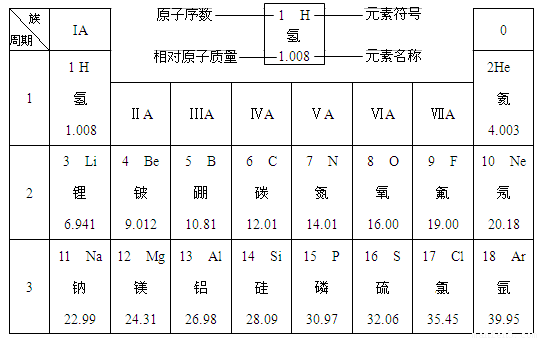
在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。
请回答:
(1)硅的相对原子质量为 ;原子序数为8的元素位于元素周期表的第 周期,元素符号为 ,它属于 (填“金属”或“非金属”)元素。
(2)原子半径:钠 镁(填“>”或“=”或“<”,下同),原子得电子能力:硫 氯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com