
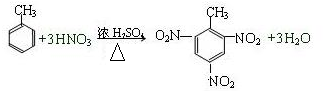

分析 (1)甲苯和浓硝酸、浓硫酸混合加热反应生成2,4,6-三硝基甲苯;
(2)丙烯发生加聚反应生成聚丙烯;
(3)CaC2和水反应生成乙炔和氢氧化钙;
(4)乙炔与溴发生加成反应生成1,1,2,2-四溴乙烷;
(5)2-溴丙烷在氢氧化钠的醇溶液中发生消去反应生成丙烯、溴化钠和水.
解答 解:(1)甲苯和浓硝酸、浓硫酸混合加热反应生成2,4,6-三硝基甲苯,反应的化学方程式为: ,
,
故答案为: ;
;
(2)丙烯发生加聚反应生成聚丙烯,化学方程式为: ,
,
故答案为: ;
;
(3)CaC2和水反应生成乙炔和氢氧化钙,反应的化学方程式为:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
故答案为:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
(4)乙炔与溴发生加成反应生成1,1,2,2-四溴乙烷,方程式:C2H2+2Br2→CH2Br2-CH2Br2,
故答案为:C2H2+2Br2→CH2Br2-CH2Br2;
(5)2-溴丙烷在氢氧化钠的醇溶液中发生消去反应生成丙烯、溴化钠和水,反应的化学方程式为:CH3-CHBr-CH3+NaOH$→_{加热}^{醇}$CH3-CH=CH2↑+NaBr+H2O;
故答案为:CH3-CHBr-CH3+NaOH$→_{加热}^{醇}$CH3-CH=CH2↑+NaBr+H2O.
点评 本题考查了有机物化学性质、反应条件、反应产物和化学方程式书写方法等知识,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:实验题
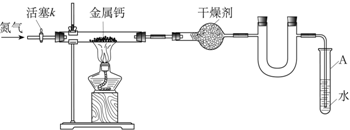
| 空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 120.8 | 122.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使 SO3 的浓度增大 | B. | 使平衡向正反应方向移动 | ||
| C. | 使平衡常数 K 增大 | D. | 使正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 水蒸气含有的分子数为1NA | |
| B. | 常温常压下,32 g O2含有的原子数为2个 | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4 L | |
| D. | 体积为1L、物质的量浓度为0.5 mol/L的氯化钙溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在测定中和热的实验中,为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| B. | 酸碱中和滴定实验中,锥形瓶要用待装液预先润洗 | |
| C. | 在测定中和热的实验中,用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 | |
| D. | 测溶液PH值时,PH试纸不能润湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变,且溶液中有Na2CO3﹒10H2O晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:100:1 | B. | 1:10-1:10-12:10-14 | ||
| C. | 14:13:12:14 | D. | 1:2:12:14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 | |
| C. | 上述实验采用相同指示剂,可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com