

 Cl-+H++HClO,故答案为:Cl2+H2O
Cl-+H++HClO,故答案为:Cl2+H2O Cl-+H++HClO;
Cl-+H++HClO;

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解
| 53(b-a) |
| 22a |
| 53(b-a) |
| 22a |
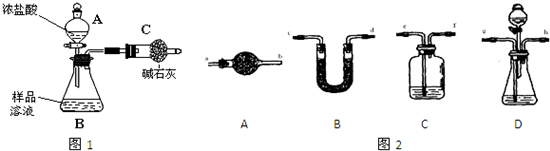
| 选用的仪器 | C C |
D D |
C C |
B B |
A A |
| 添加的药品 (必要的操作) |
装有氢氧化钠溶液,从e通入空气 装有氢氧化钠溶液,从e通入空气 |
分液漏斗装稀硫酸,锥形瓶内装样品溶液 分液漏斗装稀硫酸,锥形瓶内装样品溶液 |
浓硫酸 浓硫酸 |
碱石灰,反应前后分别称量质量 碱石灰,反应前后分别称量质量 |
碱石灰 碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 3 |
| 1 |
| 3 |

查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷带解析) 题型:实验题
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):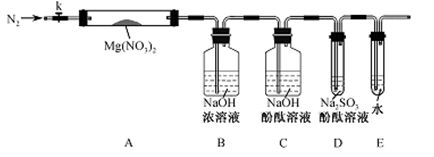
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明________
②称取Mg(NO3)2固体3 .79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:_____________________(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省成都市高三第一次诊断考试理综化学试卷(解析版) 题型:实验题
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是____ ________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
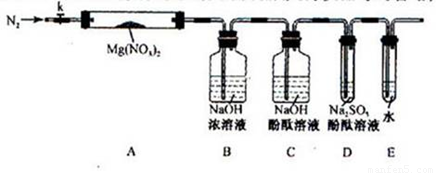
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明_ _______
② 称取Mg(NO3)2固体3 . 79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③ 观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④ 待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g
⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:_________________ ____(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(福建卷解析版) 题型:实验题
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明________
②称取Mg(NO3)2固体3 .79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是________;关闭K,用酒精灯加热时,正确操作是先________然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
① 根据实验现象和剩余固体的质量经分析可初步确认猜想_______是正确的。
② 根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:_____________________(填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是_____________________。
③ 小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com