
| A、①③ | B、②③ | C、②⑤ | D、④⑤ |


科目:高中化学 来源: 题型:
 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A、a点表示的溶液中c(CH3COO-)略小于10-3mol?L-1 |
| B、b点表示的溶液中c(CH3COO-)>c(Na+) |
| C、c点表示CH3COOH和NaOH恰好反应完全 |
| D、b、d点表示的溶液中均等于K |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原性 | B、氧化性 |
| C、碱性 | D、酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅是在地壳中的含量仅次于氧 |
| B、二氧化硅是酸性氧化物,溶于水可生成硅酸 |
| C、玛瑙、水晶的主要成分都是SiO2 |
| D、SiO2是生产光导纤维的主要材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
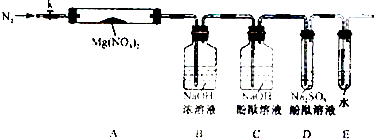 固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有自发进行的化学反应都是放热反应 |
| B、自发过程将导致体系的熵增大 |
| C、△H-T△S<0反应能自发进行 |
| D、同一物质的固、液、气三种状态的熵相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属镁与稀盐酸反应:有气泡逸出:Mg+2H++2Cl-═MgCl2+H2↑ |
| B、NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
| C、碳酸钠溶液与盐酸反应:有气泡逸出:Na2CO3+2H+═2Na++CO2↑+H2O |
| D、氯化钡溶液与稀硫酸反应:有白色沉淀生成:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com