
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子” 的说法中不正确的是 ( )
A. 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
B. 增大反应物的浓度,可使单位体积内活化分子数增多,反应速率加快
C.活化分子之间的碰撞一定是有效碰撞
D.对于有气体参加的反应通过压缩容器增大压强,可使单位体积内活化分子数增多,反应速率加快
科目:高中化学 来源: 题型:
下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液
A.①②③ B.①②③⑥ C.③⑥ D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示:
下面判断正确的是 ( )
A.原子半径: 丙<丁<戊 B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙

查看答案和解析>>
科目:高中化学 来源: 题型:
在N2+3H2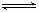 2NH3反应中,自反应开始至2 s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
2NH3反应中,自反应开始至2 s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
A.0.3 mol·L-1·s-1 B.0.4 mol·L-1·s-1 C.0.6 mol·L-1·s-1 D.0.8 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
(1)生成SO3 _________ mol;
(2)O2的转化率为_____________;
(3)平衡时体系中SO2的百分含量(体积分数)为 __________;
(4)降低温度,O2的转化率__________;v正___________;(填“增大”、“减小”或“不变”)
(5)保持容器体积不变,加入He,则SO2的物质的量_____。(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
① 6.02×1023个NH3 分子的质量为 g,
标准状况下的体积为 L ,与 g CH4中含有的氢原子数相等。
②将标准状况下2.24LHCl气体溶于水,得到100ml溶液,则:
该溶液的浓度为 。取出20ml该溶液,所取出该溶液中溶质的质量是 g,如果要将原来的100ml溶液中的HCl与NaOH恰好反应,则需要
2.0 mol·L-1的NaOH溶液的体积为 ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)分别写出由钠在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①Na2O2:________________;②Na2O:________________;
(2)指出氧在下列各物质中的化合价。
O3:________;Na2O2:________;Na2O:________。
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com