
现有四种有机化合物:
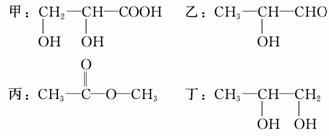
试回答:
(1)甲、乙、丁都含有的官能团的名称是________。
(2)1 mol甲、乙、丁分别与足量Na反应,生成H2最多的是________(填编号,下同)。
(3)互为同分异构体的是________。
(4)等物质的量的甲、乙、丙、丁充分燃烧,消耗氧最少的是________。
(5)丁与醋酸在催化剂作用下发生取代反应生成的酯有________种。
科目:高中化学 来源: 题型:
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 化学方程式 | 焓变ΔH (kJ·mol-1) | |
| 甲烷 氧化 | CH4(g)+2O2(g)===CO2(g)+2H2O(g) | ΔH1 |
| CH4(g)+O2(g)===CO2(g)+2H2(g) | -322.0 | |
| 蒸汽 重整 | CH4(g)+H2O(g)===CO(g)+3H2(g) | 206.2 |
| CH4(g)+2H2O(g)===CO2(g)+4H2(g) | 165.0 |
①反应CO(g)+H2O(g)===CO2(g)+H2(g)的ΔH=________ kJ·mol-1。
②甲烷的燃烧热为ΔH2,则ΔH2________ΔH1(填“>”、“=”或“<”)。
(2)物质(tBuNO)2在正庚烷溶剂中发生如下反应:
(tBuNO)22(tBuNO) ΔH。
实验测得该反应的ΔH=+50.5 kJ·mol-1,活化能Ea=90.4 kJ·mol-1。下列能量关系图合理的是________________________________________________________________________。
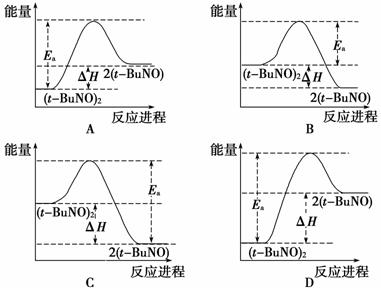
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种溶液中各含一种X-(X-为Cl-、Br-或I-)离子,向甲溶液中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化,则甲、乙、丙依次含有
A.Br-、Cl-、I- B.Br-、I-、Cl- C.I-、Br-、Cl- D.Cl-、I-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
 柠檬中含有大量的柠檬酸,因此被誉为“柠檬酸仓库”。柠檬酸的结构简式为
柠檬中含有大量的柠檬酸,因此被誉为“柠檬酸仓库”。柠檬酸的结构简式为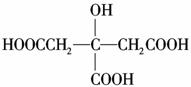 ,
,
则1 mol柠檬酸与足量的金属钠反应,最多可消耗Na的物质的量为( )
A.2 mol B.3 mol
C.4 mol D.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构式如图所示: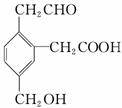 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A.②③④ B.①③⑤⑥
C.①③④⑤ D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
尼泊金甲酯是苯的含氧衍生物,在化妆品中可作防腐剂。回答下列问题:
(1)尼泊金甲酯的结构简式为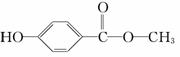 ,写出尼泊金甲酯与NaOH溶液反应的化学方程式(有机物写结构简式):_______________________
,写出尼泊金甲酯与NaOH溶液反应的化学方程式(有机物写结构简式):_______________________
___________________________________________________________________ _____。
_____。
(2)尼泊金甲酯的一种同分异构体A,满足以下条件:①含有苯环,②含有碳碳双键,③苯环上一氯取代物只有一种。写出A的可能的结构简式:____________________。
(3)尼泊金甲酯的另一种同分异构体B,其苯环上的取代基彼此相间,有如下转化关系:
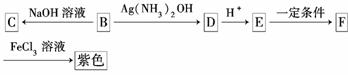
已知C的化学式为C8H7O3Na,F的化学式为C8H6O3。
填写下列空白:
①B中的官能团名称是________________,E→F的反应类型为________;
②F的结构简式为____________________;
③写出E与乙醇反应的化学方程式(有机物写结构简式,并注明反应条件):________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是________(填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
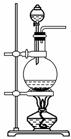 (2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是____________。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0.100 0 mol·L-1NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为____________mol·L-1;
b.平行滴定后获得实验结果。
③判断丙方案的实验结果________(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
 ④进行丁方案实验:装置如图所示(夹持器具已略去)。
④进行丁方案实验:装置如图所示(夹持器具已略去)。
(i)使Y形管中的残余清液与锌粒反应的正确操作是将________转移到________中。
(ii)反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是________(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应。其供电原理是:白天太阳能帆板发电,将一部分电量直接供给天宫一号,另一部分电量储存在镍氢电池里,供黑夜时使用。如图为镍氢电池构造示意图(氢化物电极为储氢金属,可看做H2直接参加反应)。下列说法正确的是
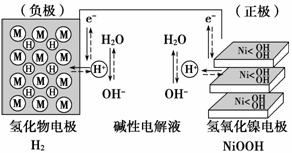
A.充电 时阴极区电解质溶液pH降低
时阴极区电解质溶液pH降低
B.在使用过程中此电池要不断补充水
C.放电时NiOOH在电极上发生氧化反应
D.充电时阳极反应为:Ni(OH)2+OH--e-===NiOOH+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com