
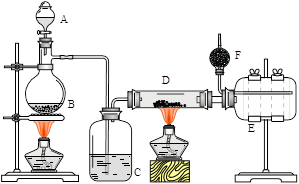
 NaHSO4 + HCl↑(1分,写强热亦可,产物为Na2SO4); (2)浓硫酸(1分),B(1分);
NaHSO4 + HCl↑(1分,写强热亦可,产物为Na2SO4); (2)浓硫酸(1分),B(1分); NaHSO4 + HCl↑。
NaHSO4 + HCl↑。

科目:高中化学 来源:不详 题型:填空题

 ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg·L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg·L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
 E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-) >c(H2CO3) |
| D.pH=11氨水与pH=3盐酸等体积混合c(Cl-)>c(NH4+)>c(OH-) =c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2溶液与Na2SO4溶液:pH="13" |
| B.醋酸与CH3COONa溶液:c(Na+)+c(H+)= c(CH3COO-)+c(OH-) |
| C.Na2CO3溶液与NaHCO3溶液:2c(Na+) = 3c(CO32-)+3c(HCO3-)+3c(H2CO3) |
| D.Na2CO3溶液与NaOH溶液: c(Na+)>c(CO32-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B.c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C.c(Na+)> c (OH-) > c(CH3COO-) >c(H+) |
| D.c(Na+)> c (OH-) > c(H+)> c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol·L-1 NH4Cl溶液:c(NH4+)<c( Cl-) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c( Cl-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com