
| A. | 标准状况下,22.4LCl2完全溶于水时转移的电子数为NA | |
| B. | 1mol羟基(-OH)含有的电子数为9NA | |
| C. | 100g30%醋酸溶液中氢原子数为2NA | |
| D. | 100mL水中OH-的个数是10-8NA |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

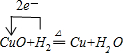
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中维生素C作还原剂 | |
| B. | 河虾与其它含维生素C较多蔬菜也不宜同食 | |
| C. | 河虾与西红柿同食发生了氧化还原反应 | |
| D. | 该反应中砷元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2++2OH-═Mg(OH)2↓ | B. | Mg(OH)2+2H+═2Mg2++2H2O | ||
| C. | Mg(OH)2═MgO+H2O | D. | MgCl2═Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
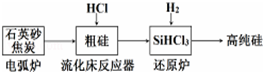
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$si+2CO |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 温度/K | 锌 | c(Zn2+)/mol/L | c(H+)/mol/L | 另加溶液 |
| A | 281 | 锌块 | 0.1 | 3 | |
| B | 308 | 锌粉 | 0.2 | 3 | 少量氯化铜 |
| C | 281 | 锌块 | 0.1 | 2 | |
| D | 308 | 锌粉 | 0.1 | 3 | 少量氯化钡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 | |
| B. | I mol Cl2与足量的铁反应,转移的电子数为3NA | |
| C. | 1 L0.1 mol•L-1氨水含有0.l NA个OH- | |
| D. | I mol乙醇中含有C-H键的数目为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com