
| 容器代码 | A | B | C | D |
平衡时 (混) (混) | | | 16 | 17 |
| 平衡时N2转化率 | 20% | ① | ② | ③ |
| 平衡时H2转化率 | | 30% | | |
科目:高中化学 来源:不详 题型:填空题
 C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1| A.容器的体积不变,增加水蒸气的物质的量 | B.缩小容器的体积,增大压强 |
| C.及时将水煤气从容器中移走 | D.其他条件不变,升高温度 |
 ③又知C(s)+CO2(g) 2CO(g) △H=+172.5kJ·mol-1
③又知C(s)+CO2(g) 2CO(g) △H=+172.5kJ·mol-1 则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。 (2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图:
(2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图: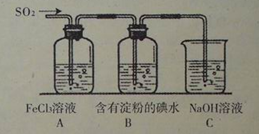
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的( )
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的( )| A.容器内气体颜色先变深后变浅,最后比原来还要浅 |
| B.反应向正反应方向移动 |
| C.NO2的转化率变小 |
| D.N2O4的体积分数一定增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.反应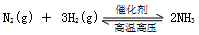 的化学平衡常数表达式为 的化学平衡常数表达式为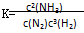 |
| B.化学平衡常数、弱电解质的电离平衡常数、溶度积常数均只受温度的影响 |
| C.对于弱电解质的电离平衡常数,当温度一定时,电离平衡常数越小,其酸性越强 |
| D.将AgNO3溶液和KCl溶液混合后,若c(Ag+)·c(Cl-)<KSP(AgCl),则溶液中无沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2(g) ,ΔH>0,达到平衡,下列说法正确的是( )
CO(g)+H2(g) ,ΔH>0,达到平衡,下列说法正确的是( )| A.升高温度,平衡向逆反应方向移动 |
| B.加入固体碳,平衡向正反应方向移动 |
| C.加入水蒸气,平衡向逆反应方向移动 |
| D.扩大容器体积,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g);
2SO3(g);
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤⑥ | B.②③④⑦. | C.①③⑤⑦ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
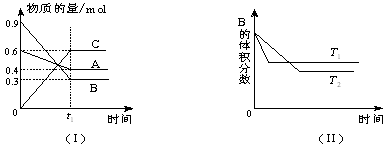
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
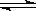 CO2(g)+H2(g)△H<0 试回答下列问题
CO2(g)+H2(g)△H<0 试回答下列问题 :
: 若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=
若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K= 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com