
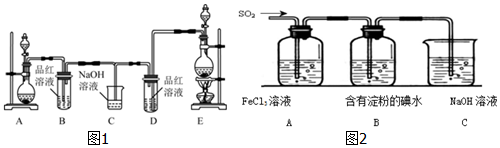
分析 (1)根据反应条件选择装置,根据方程式可以判断浓盐酸的性质;
(2)二氧化硫能够使品红溶液褪色,但是不稳定受热易恢复颜色;氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;二氧化硫与氢氧化钠反应生成亚硫酸钠;
(3)二氧化硫有还原性,氯气有氧化性,根据SO2与Cl2以体积比1:1写反应;
(4)二氧化硫为酸性氧化物,能与碱性氧化物、碱发生反应;二氧化硫能漂白某些有色物质,如使品红溶液褪色;二氧化硫中硫为+4价,属于中间价态,有氧化性又有还原性,以还原性为主,如二氧化硫能使氯水、溴水、KMnO4溶液褪色,体现了二氧化硫的强还原性而不是漂白性;
(5)A、B中蓝色褪去,说明二氧化硫和碘单质反应,依据氧化还原反应中还原剂的还原性大于还原产物分析;
B、二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收;
C、二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色;
D、铁离子氧化二氧化硫为硫酸,加入氯化钡生成沉淀说明反应进行.
解答 解:(1)实验室制氯气应是固体和液体加热生成;又由反应4molHCl中有2mol盐酸中的氯元素化合价升高,做还原剂,表现还原性,还有2mol化合价不变与金属阳离子结合成盐表现出酸性;
故答案为:E;酸性、还原性;
(2)A装置生成二氧化硫使品红溶液褪色,但是不稳定受热易恢复颜色;氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,二氧化硫与氢氧化钠反应生成亚硫酸钠,离子反应方程式为:SO2+2OH-=SO32-+H2O;
故答案为:溶液又变为红色;Cl2+2OH-=Cl-+ClO-+H2O;SO2+2OH-=SO32-+H2O;
(3)二氧化硫有还原性,氯气有氧化性,SO2与Cl2以体积比1:1混合后通入水中,发生氧化还原反应:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)①二氧化硫使品红溶液褪色体现其漂白性;
②二氧化硫使酸性KMnO4溶液褪色,体现其还原性;
③二氧化硫使溴水褪色,体现其还原性;
④二氧化硫使滴入酚酞的烧碱溶液褪色,是因为二氧化硫为酸性氧化性,与氢氧化钠反应;
⑤二氧化硫使淀粉-碘溶液褪色,体现其还原性;
所以反应实质相同的是②③⑤;
故答案为:D;
(5)A、B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故A正确;
B、二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,故B正确;
C、二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故C错误;
D、铁离子氧化二氧化硫为硫酸,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,加入氯化钡生成沉淀说明反应进行生成了硫酸根离子,故D正确;
故答案选:C.
点评 本题考查了氯气的实验室制备,次氯酸和二氧化硫的漂白性,二氧化硫、铁及其化合物性质分析判断,难度不大,掌握基础是关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 | |
| B. | 向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<Ksp(CuS) | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq) | |
| D. | 向2mL浓度均为1.2mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{O}_{3}^{-}C)•c(O{H}^{-})}{c(C{O}_{3}^{2-})}$不变 | |
| B. | 通入CO2,溶液pH增大 | |
| C. | 升高温度,平衡常数减小 | |
| D. | 加入NaOH固体,$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁可用作红色油漆和涂料 | B. | 氧化铝可制耐高温实验材料 | ||
| C. | 明矾可用作净水剂 | D. | 用铝制餐具长时间存放碱性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的CO2和水蒸气的混合气体与少量的Na2O2充分反应,最终必生成NaOH | |
| B. | 足量的MnO2与含4molHCl的浓盐酸加热充分反应,产生的Cl2必为1mol | |
| C. | 含2molHCl的某盐酸滴入足量的碳酸钠溶液中充分反应后,得到CO2气体必为1mol | |
| D. | 过量的二氧化碳通入偏铝酸钠溶液中,最终生成的产物必为Al(OH)2和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
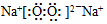 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氯气:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 实验室制二氧化硫:Cu+SO42-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 实验室用浓氨水与生石灰制氨气:NH3•H2O+CaO═Ca(OH)2+NH3↑ | |
| D. | 实验室制二氧化氮:3Cu+4H++2NO3-═3Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com