
��10�֣��״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO(g)+ 2H2(g)  CH3OH(g) ��H1����116 kJ��mol-1
CH3OH(g) ��H1����116 kJ��mol-1
��1�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ���_____________��
A����ʱ��CH3OH�뷴Ӧ��������
B�����ͷ�Ӧ�¶�
C��������ϵѹǿ
D��ʹ�ø�Ч����
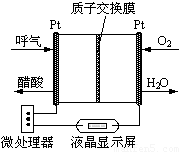
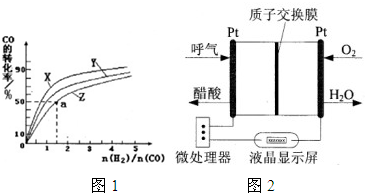
��2���Ҵ�ȼ�ϵ�ؾ��кܸߵ�ʵ�ü�ֵ����ͼ��ʾ��һ������ȼ�ϵ�ؾƾ�����ǣ������Զ����������������ƵĹ��ܣ��dz��ʺϽ����ֳ��ƾ���⡣��õ�صĸ�����ӦʽΪ ��
��3����֪��CO(g)+1/2 O2(g)=CO2(g)����H2����283 kJ��mol-1
H2(g)+1/2 O2(g)=H2O(g) ��H3����242 kJ��mol-1
���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ
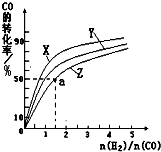
��4�����ݻ�Ϊ2L�ĺ��������У��ֱ��о���230�桢250���270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ2mol����COƽ��ת���ʵĹ�ϵ����ش�
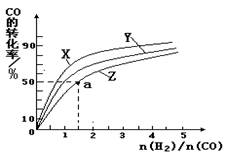
�������������¶��У�����Z��Ӧ�� ��
������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO(g)+ 2H2(g) CH3OH(g) ��ƽ�ⳣ��K = ��
CH3OH(g) ��ƽ�ⳣ��K = ��
��1��CD ��2��CH3CH2OH��H2O��4e����CH3COOH��4H��
��3��CH3OH(g)+3/2O2(g) ��CO2(g)+ 2H2O(g) ��H����651kJ��mol-1
��4����270�� ��4
��������
�����������1������Ũ�ȡ������¶ȡ�����ѹǿ��ʹ�ô������ܼӿ컯ѧ��Ӧ���ʣ�����ѧ��Ӧ���ʻή�ͣ���ѡCD����2��ԭ����еĸ���ʧȥ���ӣ����������Ե�ȼ�ϵ�أ����Ը�����ӦʽΪ��CH3CH2OH��H2O��4e����CH3COOH��4H������3������3���е�2���Ȼ�ѧ����ʽ*2�ںͣ�3���еĵ�һ���Ȼ�ѧ����ʽ�����ټ�ȥ���е��Ȼ�ѧ����ʽ���ɵý�Ϊ��CH3OH(g)+3/2O2(g) ��CO2(g)+ 2H2O(g) ��H����651kJ��mol-1��
���㣺�ø�˹���ɽ����йط�Ӧ�ȵļ���缫��Ӧ�͵�ط�Ӧ����ʽ��ѧƽ�ⳣ���ĺ���
���������⿼��ѧ���йػ�ѧƽ���Լ��Ȼ�ѧ֪ʶ��ѧ�����Ը�����ѧ֪ʶ���ش��ѶȽϴ�


 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1
�״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�������ʡ˫Ѽɽ�и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ������
ŷ��ԭ����2012��1��1�������պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȡ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1�����������ҹ���������̼���о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼�����������ʣ�������̼���������������������ᴿ���䷴Ӧ�Ļ�ѧ����ʽΪ��
__C+__K2Cr2O7+__ ��__CO2��+ __K2SO4 + __Cr2(SO4)3+__H2O
����ɲ���ƽ������ѧ����ʽ��
��2���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+ 2H2��g�� CH3OH��g�� ��H1����116 kJ��mol-1
CH3OH��g�� ��H1����116 kJ��mol-1
�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ��� _______��
A����ʱ��CH3OH�뷴Ӧ�������� B�����ͷ�Ӧ�¶�
C��������ϵѹǿ D��ʹ�ø�Ч����
����֪�� ��H2����283 kJ��mol-1
��H2����283 kJ��mol-1
 ��H3����242 kJ��mol-1
��H3����242 kJ��mol-1
���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
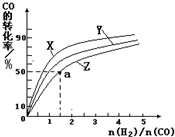
�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250���270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ����ش�:

���������������¶��У�����Z��Ӧ���¶���
��������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO��g��+ 2H2��g��  CH3OH��g����ƽ�ⳣ��K =
��
CH3OH��g����ƽ�ⳣ��K =
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com