
����ʵ���ܴﵽԤ��Ŀ�ĵ���
��� | ʵ������ | ʵ��Ŀ�� |
A | �����£���pH��ֽ�ֱ�ⶨŨ��Ϊ0.1mol/L NaClO��Һ��0.1mol/L CH3COONa��Һ��pH | �Ƚ�HClO��CH3COOH������ǿ�� |
B | ���з�̪��Na2CO3��Һ�м�������BaCl2���壬��Һ��ɫ��dz | ֤��Na2CO3��Һ�д���ˮ��ƽ�� |
C | ��10ml0.2mol/L��Һ�е���2��0.1mol/LMgCl2��Һ��������ɫ�������ٵμ�2��0.1mol/L FeCl2��Һ�������ɺ��ɫ���� | ֤������ͬ�¶���Kap��Mg(OH)2��Fe(OH)3 |
D | �ֱ�ⶨ�����µ����ʵ���Ũ�ȵ�Na2SO3��Na2CO3��Һ��pH���߽ϴ� | ֤���ǽ�����S��C |
 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��һ�ϵ�һ�ο��Ի�ѧ���������棩 ���ͣ�ѡ����
ʵ����������480mL 0.1mol/L������ͭ��Һ������ʱӦѡ�������ƿ�Ĺ�����Ҫ���������ʵ������ֱ�Ϊ
A��480mL����ƿ��7.68g����ͭ B��480mL����ƿ��12.0g����
C��500mL����ƿ��12.5g����ͭ D��500mL����ƿ��12.5g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��1L��0.01molNaAlO2��0.02molNaOH����Һ�л���ͨ�������̼����n(CO2)�������ж�Ӧ��ϵ��ȷ����( )
ѡ�� | n(CO2)/mol | ��Һ�����ӵ����ʵ���Ũ�� |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10.6�ܲ⻯ѧ�Ծ��������棩 ���ͣ������
��1�����������ʢ�Cu ��Һ�� ��CH3COOH ��NaHCO3 ��H2O ������NaCl ��NH3��H2O ��NH4Cl ����������ʵ��� ������ţ���
��ѧʽ | NH3��H2O | HCN | CH3COOH | H2CO3 |
����ƽ�ⳣ����25�棩 | Kb=1.77��10��5 | Ka=4.93��10��10 | Ka=1.76��10��9 | Ka1=4.30��10��7 Ka2=5.61��10��11 |
��2������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ���������ϱ��и�������������ʵĵ���ƽ�ⳣ�������п����жϣ�����ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ��������ɴ�С��˳��Ϊ ��
��3������ˮ��̶ȵ�ǿ��ͬ����������ʵĵ���̶���һ����ϵ����ϱ������ݻش��������⣺
��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ b��Na2CO3��Һ c��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ ��������Һǰ��ţ�
��Ũ����ͬ��NaCN��Һ��CH3COOK��Һ��ȣ�c(Na+)��c(CN��) c(K+)��c(CH3COO��)�����������������=����
�۽�����������ʵ���Ũ�ȵ�����Ͱ�ˮ��Ϻ���Һ�� �ԣ���ᡱ��������С����������ӷ���ʽ��ʾԭ�� ��
�������£�����0.1mol��L��1�������20ml0.1mol��L��1��ˮ�У���ҺpH�������������ı仯��������ͼ��ʾ��b����ʾ��Һ�е������� ��
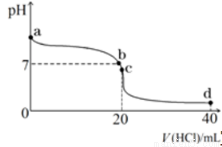
��NH4HCO3��Һ�� �ԣ���ᡱ��������С�����
��4����ϱ������ݣ���NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10.6�ܲ⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ����ʢ��50mlpH=2��HA��Һ�ľ��������м���pH=13��NaOH��Һ������NaOH��Һ�������V�������û����Һ���¶ȣ�T���Ĺ�ϵ��ͼ��ʾ������������ȷ����

A��HA��Һ�����ʵ���Ũ��Ϊ0 0l mol��L��1
B��b��c�Ĺ����У��¶Ƚ��͵�ԭ������Һ�з��������ȷ�Ӧ
C��a��b�Ĺ����У������Һ�п��ܴ��ڣ�c(A��)=c(Na+)
D��25��ʱ��HA�ĵ���ƽ�ⳣ��KԼΪ1.43��10��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10.6�ܲ⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���20mL0.2mol/L H2A��Һ�еμ�0.2mol/LNaOH��Һ���й������ʵ����仯����ͼ������I����H2A��II����HA����III����A2����������ͼʾ�ж�����˵����ȷ����

A����y(NaOH)=20mLʱ����Һ������Ũ�ȴ�С��ϵ��c(Na+)��c(HA��)��c(H+)��c(A2��)��c(OH��)
B���������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
C����ʹNaHA��Һ�����ԣ����������м�������
D����NaHA��Һ����ˮ�Ĺ����У�pH��������Ҳ���ܼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������10.6�ܲ⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ԫ��H2A��ˮ�еĵ�������ǣ�H2A=H++HA����HA�� H++A2�������������ʵ�ˮ��Һ������Ũ��֮����ڵĹ�ϵ�������
H++A2�������������ʵ�ˮ��Һ������Ũ��֮����ڵĹ�ϵ�������
A��NaHA��c(Na+)=c(A2��)+c(HA��)+c(H2A)
B��NaHA��c(Na+)��c(HA��)��c(H+)��c(OH��)
C��Na2A��c(Na+)��c(A2��)��c(OH��)��c(H+)
D��H2A��c(H+)=c(HA��)+2c(A2��)+c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ������ѧ�ڵ�һ���¿���ѧ���������棩 ���ͣ�ѡ����
��ˮ�мӵ����ʵ�����Ag+��Pb2 +��Na +�� SO42 -�� NO3- �� Cl-������Һ�����ö��Ե缫���缫�ĵ����У�ͨ��Ƭ�̣������������뻹ԭ��������
-�� NO3- �� Cl-������Һ�����ö��Ե缫���缫�ĵ����У�ͨ��Ƭ�̣������������뻹ԭ�������� ��Ϊ�� ��
���� ��
A��35.5:108 B�� 16:207 C��8:1 D��108:35.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶���9���¿���ѧ���������棩 ���ͣ�ʵ����
ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�顣�������������գ�
����һ������100mL 0.10mol/L NaOH����Һ��
�������ȡ20.00mL����ϡ���������ƿ�У����μ�2��3�η�̪��Һ��ָʾ�������Լ����Ƶı�NaOH��Һ���еζ����ظ������ζ�����2��3�Σ���¼�������¡�
ʵ�� ��� | NaOH��Һ ��Ũ��(mol/L) | �ζ����ʱ������NaOH ��Һ�����(mL) | ����������Һ�����(mL) |
1 | 0.10 | 22.02 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.98 | 20.00 |
��1���ζ��ﵽ�յ�������� ����ʱ��ƿ����Һ��pH�ķ�Χ�� ��
��2�������������ݣ��ɼ�����������Ũ��Ϊ ��
��3����ȥ��ʽ�ζ��������ݵķ���Ӧ������ͼ�� ������Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��


��4����ͼ��ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ________mL��
��5�����в���(����������ȷ)����ɲⶨ���(����ҺŨ��ֵ)ƫ�͵��� ��
A�����Ʊ���Һ����ʱ����ˮ�����̶�
B����ƿˮϴ��ֱ��װ����Һ
C����ʽ�ζ���ˮϴ��δ�ô���ϡ������Һ��ϴ
D���ζ������յ�ʱ�����Ӷ����ζ��ܶ�����
E����ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com