

| A.溶解 | B.过滤 | C.蒸发 | D.焰色反应 |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:不详 题型:单选题
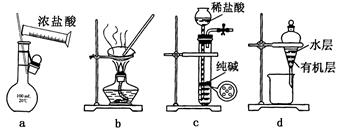
| A.用图a所示装置配制100mL0.100mol·L-1稀盐酸 |
| B.用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 |
| C.用图c所示装置制取少量纯净的CO2气体 |
| D.用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.圆底烧瓶可以直接用酒精灯加热 |
| B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
| C.酒精灯着火时可用水扑灭 |
| D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.450 mL,52.7 g | B.500 mL,58.5 g |
| C.450 mL,58.5 g | D.500 mL,52.7 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 Na2S2O3,
Na2S2O3,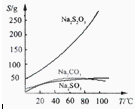
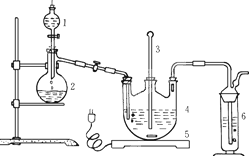
| A.BaCl2溶液 | B.浓H2SO4 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
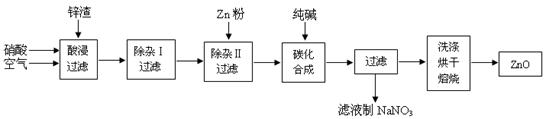
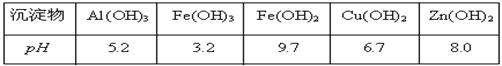
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用托盘天平称取8 g NaOH固体(NaOH固体放置于天平的托盘上),放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL |
| C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D.用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,在不断搅拌下慢慢倒入烧杯中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com